-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡 常数 | Ka=1.8×10-5 |  = =
4.3×10-7 |  = =
5.6×10-11 | Ka= 3.0×10-8 |
| | | | |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
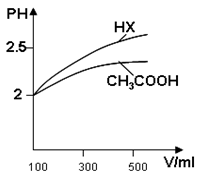
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。
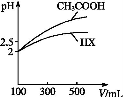
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值), = 。
= 。
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3;
pH由小到大的排列顺序是______(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是______(填序号)
A.c(H+) B.c(H+)/c(CH3COOH)C.c(H+)•c(OH-)D.c(OH-)/c(H+)
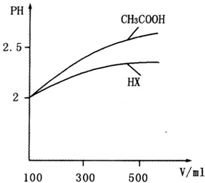
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.理由是:______.
(4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=______mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=______.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是________(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是________
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
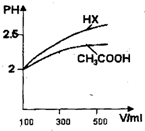
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________CH3COOH的电离平衡常数(填大于、小于或等于)理由是________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是________(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是________
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
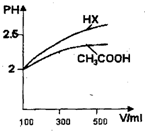
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________CH3COOH的电离平衡常数(填大于、小于或等于)理由是________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| | | | |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
A.c(H+) B.c(H+)/ c(CH3COOH) C. c(H+)·c(OH-) D. c(OH-)/ c(H+)
E. c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
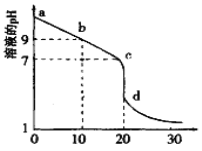
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
-
25℃时,几种物质的电离平衡常数如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
下列叙述正确的是
A. HClO的漂白性是因为酸性很弱
B. 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大
C. 反应 2C1O- +CO2+H2O=CO32-+2HClO可以发生
D. 稀释醋酸溶液,则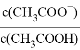 的数值随水量的增加而增大
的数值随水量的增加而增大
-
根据表提供的数据,下列判断正确的是
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A H++HA-;HA-
H++HA-;HA- H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:
C(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
-
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
-
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是 。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。






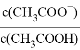 的数值随水量的增加而增大
的数值随水量的增加而增大