-
已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡 常数 | Ka=1.8×10-5 |  = =
4.3×10-7 |  = =
5.6×10-11 | Ka= 3.0×10-8 |
| | | | |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO
d.NaHCO3;pH由小到大的排列顺序是 (用字母表示)。
(2)常温下,0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
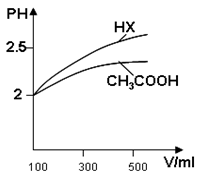
(3)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数 (填“大于”“小于”或“等于”)CH3COOH的电离平衡常数。理由是 。
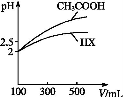
(4)25 ℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值), = 。
= 。
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3;
pH由小到大的排列顺序是______(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是______(填序号)
A.c(H+) B.c(H+)/c(CH3COOH)C.c(H+)•c(OH-)D.c(OH-)/c(H+)
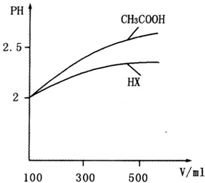
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.理由是:______.
(4)25℃时,在CH3COOH与CH3COONa的混合溶液中,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=______mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=______.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是________(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是________
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
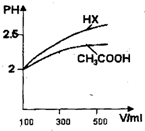
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________CH3COOH的电离平衡常数(填大于、小于或等于)理由是________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-4 |
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3;pH由小到大的排列顺序是________(用字母表示)
(2)常温下,0.1mol•L-1的CH3COOH溶液加稀释过程中,下列表达式的数据变大的是________
A.c(H+)B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-)D.c(OH-)/c(H+)
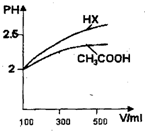
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________CH3COOH的电离平衡常数(填大于、小于或等于)理由是________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol•L-1(填精确值),c(CH3COO-)/c(CH3COOH)=________.
-
已知25℃时部分弱电解质的电离平衡常数数据如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| | | | |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液:a.CH3COOH b.Na2CO3 c.NaClO d.NaHCO3; PH由小到大的排列顺序是___________________________
(2)常温下,0.1mol·L-1的的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是____
A.c(H+) B.c(H+)/ c(CH3COOH) C. c(H+)·c(OH-) D. c(OH-)/ c(H+)
E. c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mlPH=2的CH3COOH与一元酸HX,加水稀释过程中PH与溶液体积的关系如图所示,则HX的电离平衡常数_________CH3COOH的电离平衡常数(填大于小于或等于)理由是______________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得PH=6,则溶液中C(CH3COO-)—c(Na+)=____________mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=__________
-
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
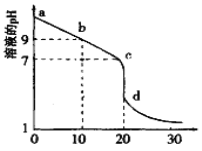
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
-
25℃时,几种物质的电离平衡常数如下表:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
下列叙述正确的是
A. HClO的漂白性是因为酸性很弱
B. 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大
C. 反应 2C1O- +CO2+H2O=CO32-+2HClO可以发生
D. 稀释醋酸溶液,则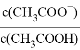 的数值随水量的增加而增大
的数值随水量的增加而增大
-
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
(1)已知25℃时,①HF(aq)+OH—(aq)=F—(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH—(aq)=H2O(l) ΔH=-57.3kJ/mol ,
氢氟酸的电离方程式及热效应可表示为________________________。
(2)将浓度为0.1 mol/LHF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH—) C. D.
D.
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
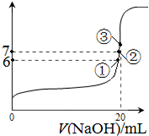
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F—)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F—)=c(Na+)
D.③点时V=20mL,此时溶液中c(F—)< c(Na+)=0.1mol/L
(4)物质的量浓度均为0.1mol/L的下列四种溶液: ① Na2CO3溶液 ② NaHCO3溶液 ③ NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(5)Na2CO3溶液显碱性是因为CO32—水解的缘故,请设计简单的实验事实证明之
___________________________________________________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,每生成1molHF转移________mol电子。
-
根据表提供的数据,下列判断正确的是
| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.8×10-6 | 3.0×10-8 | Ka1=4.3×10-7 Ka2=5.6×l0-11 |
A. 等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(CH3COO-)
B. 常温下,已知酸H2A存在如下平衡:H2A H++HA-;HA-
H++HA-;HA- H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
H++A2-(Ka1=5.9×10-2,Ka2=6.4×10-6),则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C. 相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:
C(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D. 常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
-
已知部分弱酸的电离平衡常数如表所示
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A. CO2+H2O +2C1O- =CO32-+2HClO
B. 2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O
C. SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO
D. SO2+CO32-=CO2+SO32-

= 。





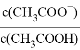 的数值随水量的增加而增大
的数值随水量的增加而增大 D.
D.
