-
阿司匹林具有抗血小板凝聚的作用。其有效成分是乙酰水杨酸(C9H8O4)。乙酰水杨酸属于
A. 单质 B. 氧化物 C. 氢化物 D. 有机化合物
难度: 中等查看答案及解析
-
下列各组元素中,属于同一主族的是
A. N、Cl B. O、S C. H、Mg D. Na、 Al
难度: 中等查看答案及解析
-
电解质是一类在水溶液里或熔融状态下能够导电的化合物。下列物质属于电解质的是
A. 碳 B. 氯化钾溶液 C. 氢氧化钠 D. 稀硫酸
难度: 中等查看答案及解析
-
下列物质属于高分子化合物的是
A. 乙烷 B. 乙醇 C. 聚乙烯 D. 乙酸乙酯
难度: 中等查看答案及解析
-
下列关于Na性质的描述不正确的是
A. 密度大于水 B. 银白色固体 C. 与水反应 D. 熔点较低
难度: 中等查看答案及解析
-
下列同周期元素中,原子半径最大的是
A. Al B. Mg C. Si D. Cl
难度: 中等查看答案及解析
-
当光束通过下列分散系时,能观察到丁达尔效应的是
A. 乙醇溶液 B. 葡萄糖溶液 C. 氢氧化钠溶液 D. 氢氧化铁胶体
难度: 中等查看答案及解析
-
下图为某城市某日空气质量报告,下列叙述与报告内容不相符的是

A. 该日空气首要污染物是PM10
B. 该日空气质量等级属于中度污染
C. 污染物NO2、CO可能主要来源于机动车尾气
D. PM2.5、PM10指的是悬浮颗粒物,会影响人体健康
难度: 中等查看答案及解析
-
丝绸之路贸易中的下列商品,主要成分属于合金的是
A.青铜器皿
B.陶瓷
C.丝绸
D.中草药

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质中,只含有离子键的是
A. NaOH B. CO2 C. MgCl2 D. Na2O2
难度: 中等查看答案及解析
-
催化还原CO2是解决温室效应及能源问题的重要手段之一。在恒容密闭容器中,CO2和H2在催化剂作用下发生反应:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g)。CO2、H2、CH3OH、H2O的浓度均不再改变时,下列说法正确的是
A. CO2、H2、CH3OH、H2O的浓度一定相等
B. 该反应已经达到化学平衡状态
C. CO2和H2完全转化为CH3OH和H2O
D. CO2、H2的反应速率等于CH3OH、H2O的反应速率且为零
难度: 中等查看答案及解析
-
原电池原理的发现改变了人们的生活方式。关于下图所示原电池的说法不正确的是
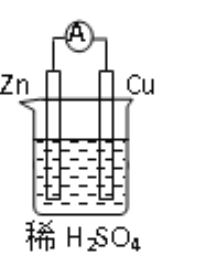
A. 该装置将化学能转化为电能
B. 电子由铜片经导线流向锌片
C. 铜片上发生的反应为2H+ + 2e-
H2
D. 该装置使氧化反应和还原反应分别在两个不同的区域进行
难度: 中等查看答案及解析
-
碘(
)可用于医学放射的贝塔射线破坏甲状腺滤泡或杀死癌细胞而达到治疗甲亢、甲状腺癌和甲状腺癌转移灶的目的。下列关于
的说法正确的是
A. 质子数为53 B. 中子数为131
C. 质量数为184 D. 核外电子数为78
难度: 中等查看答案及解析
-
糖类、油脂和蛋白质是生命活动所必需的营养物质。下列物质中不属于糖类的是
A. 蔗糖 B. 淀粉 C. 葡萄糖 D. 油脂
难度: 中等查看答案及解析
-
下列反应属于加成反应的是
A. 乙醇与氧气反应生成乙醛 B. 甲烷与氯气反应生成一氯甲烷
C. 乙烯与溴反应生成1,2-二溴乙烷 D. 乙醇与乙酸反应生成乙酸乙酯
难度: 中等查看答案及解析
-
下列方法不能用来鉴别乙醇和乙酸的是
A. 观察溶液颜色 B. 加入碳酸氢钠溶液
C. 加入紫色石蕊溶液 D. 加入酸性高锰酸钾溶液
难度: 中等查看答案及解析
-
某粒子的结构示意图为
, 关于该粒子的说法正确的是
A. 核外电子数为16 B. 在化学反应中易得电子
C. 属于金属元素 D. 在周期表中位于第3周期 第ⅥA族
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是
A.
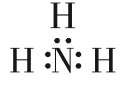 B.
B. C.
D.
难度: 中等查看答案及解析
-
下列关于自然界中氮循环(如图)的说法不正确的是

A. 雷电作用是氮元素被氧化
B. 豆科植物的根瘤固氮属于人工固氮
C. 含氮无机物和含氮有机物可相互转化
D. 碳、氢、氧三种元素也参与了氮循环
难度: 中等查看答案及解析
-
控制变量是科学研究的重要方法。向2 mL H2O2溶液中滴入2滴1 mol/LCuSO4溶液,下列条件下分解速率最快的是
选项
A
B
C
D
H2O2溶液的物质的量浓度(mol·L−1)
1
1
4
4
反应的温度(℃)
5
40
5
40
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
实验室中,下列行为不符合安全要求的是
A. 稀释浓硫酸时,将浓硫酸缓慢注入水中并搅拌
B. 实验结束后将废液倒入指定容器中
C. 金属钠着火时,立即用水扑灭
D. 在通风橱内制备有毒气体
难度: 中等查看答案及解析
-
下列说法中,正确的是
A. 标准状况下,3.6 g H2O的物质的量为0.1 mol
B. 常温常压下,11.2 L N2物质的量为0.5 mol
C. 1 mol/L MgCl2溶液中Cl-的物质的量为1 mol
D. 22 g CO2的摩尔质量为44g/mol
难度: 中等查看答案及解析
-
下列解释事实的离子方程式书写不正确的是
A. 向氯化铁溶液中加入铁粉,颜色变浅:Fe3++ Fe
2Fe2+
B. 向碳酸钠溶液中滴加稀盐酸,产生气体:CO32-+ 2H+
CO2↑ + H2O
C. 向氯化钠溶液中滴加硝酸银溶液,生成沉淀:Ag+ + Cl-
AgCl ↓
D. 向氯化钡溶液中滴加稀硫酸,生成沉淀:Ba2++ SO42-
BaSO4 ↓
难度: 中等查看答案及解析
-
下列实验装置或操作与实验目的不相符的是
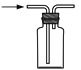

A.除去水中泥沙
B.收集氨气
C.分离CCl4和H2O
D.配制100 mL 0.1 mol·L−1 NaCl溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列“解释或结论”与“实验操作及现象”不对应的是
选项
实验操作及现象
解释或结论
A.
向某溶液中逐滴加入盐酸,产生无色无味气体
此溶液中一定含有CO32-
B.
将干燥和湿润的红色布条,分别放入盛有氯气的集气瓶中,湿润的红色布条褪色
氯气与水反应一定产生具有漂白性的物质
C.
将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近,产生大量白烟
NH3遇到HCl时反应生成NH4Cl晶体
D.
向某溶液中逐滴加入NaOH溶液,立即产生白色沉淀,迅速变成灰绿,最终变成红褐色
此溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析