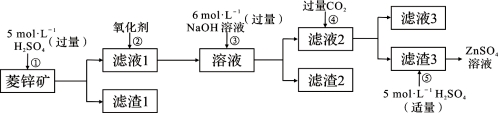
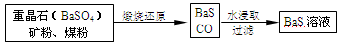
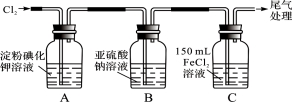
-
化学与生活密切相关,下列说法不正确的是
A.饮用牛奶和豆浆可以缓解重金属引起的中毒
B.向煤中加入适量石灰石,可减少其燃烧产物中的SO2,降低对大气的污染
C.食品包装袋、食物保鲜膜等材料的主要成分是聚氯乙烯
D.混凝法、中和法和沉淀法是污水处理中常用的化学方法
难度: 中等查看答案及解析
-
下列判断正确的是
A.HClO4、H2SO4、CH3COOH、H2CO3酸性依次减弱
B.Cl-、Na+、Mg2+、F-的半径依次减小
C.Na、Mg、Al失电子能力随最外层电子的增加而增强
D.HI、HBr、HCl、HF的沸点依次降低
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
选项
实验操作
实验目的
A
向FeCl3溶液中滴加NaOH溶液
制备Fe(OH)3胶体
B
将CO2通入水玻璃溶液中
证明C元素的非金属性大于Si
C
向苯和苯酚的混合溶液中加入足量的浓溴水,充分反应后过滤
除去苯中混有的苯酚
D
淀粉与稀H2SO4共热,再加入银氨溶液水浴加热
验证淀粉水解产物有无还原性
难度: 中等查看答案及解析
-
常温下,下列各组离子在给定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.Kw=1.01×10-14的某无色溶液:NH4+、K+、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、Ba2+、HCO3-、NO3-
D.由水电离出来的c(H+)=1.0×10-13 mol·L-1的溶液:K+、Na+、NO3-、Cl-
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法正确的是
A.12.4 g白磷中含有共价键数为0.4 NA
B.3Fe+4H2O(g)
Fe3O4+4H2反应中,当5.6 g Fe全部转化为Fe3O4时,则有0.3 NA电子发生转移
C.在1 L 0.1 mol/L碳酸钠溶液中阴离子总数等于0.1 NA
D.在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c (OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
D.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
某温度T1时,向容积为2 L的恒容密闭容器中充入一定量的H2和I2(g),发生反应:H2(g)+I2(g)
2HI(g)反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min
n(H2)/mol
n(I2)/mol
0
0.9
0.3
t1
0.8
t2
0.2
下列说法正确的是
A.反应在t1 min内的平均速率为:v(H2)=
mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20 mol H2,与原平衡相比,达到新平衡时I2(g)转化率增大,H2的体积分数不变
C.保持其他条件不变,起始时向容器中充入的H2和I2(g)都为0.5mol,达到平衡时n(HI)=0.2 mol
D.升高温度至T2时,上述反应平衡常数为0.18,则正反应为吸热反应
难度: 中等查看答案及解析
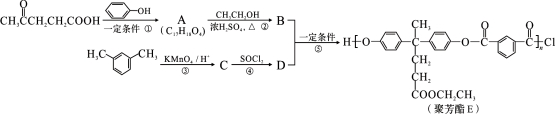
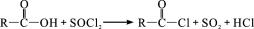
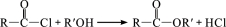 (R、R′表示烃基)
(R、R′表示烃基)