-
化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用 ②研发易降解的生物农药 ③应用高效洁净的能源转化技术
④田间焚烧秸秆 ⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 中等查看答案及解析
-
下列与有机物结构、性质相关的叙述错误的是
A.用水可区分苯和溴苯
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
难度: 中等查看答案及解析
-
下列有机物分子中,所有原子一定在同一平面内的是
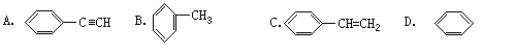
难度: 中等查看答案及解析
-
1体积气态烃和2体积氯化氢恰好完全发生反应后,其产物最多还能和8体积氯气发生取代反应,由此可以推断原气态烃是(气体体积均在相同条件下测定)
A.乙炔 B.1,3-丁二烯 C.戊炔 D.丙炔
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.黄绿色的氯水光照后颜色变浅
B.
对该平衡体系加压后颜色加深
C.由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
D.在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
难度: 中等查看答案及解析
-
苹果酸的结构简式为
,下列说法正确的是
A.HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
B.1mol苹果酸可与3mol NaOH发生中和反应
C.1mol苹果酸与足量金属Na反应生成生成1mol H2
D.苹果酸在一定条件下能发生缩聚反应
难度: 中等查看答案及解析
-
已知分解1mol H2O2放出热量98kJ。在含有少量I
的溶液中,H2O2分解的机理为:
H2O2+ I
H2O+IO
慢 H2O2+ IO
H2O+O2+ I
快
下列有关该反应的说法正确的是
A.反应速率与I
浓度有关
B.IO
也是该反应的催化剂
C.反应活化能等于98kJ·mol-1
D.
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.N2(g)+3H2(g)
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v (H2)和氢气的平衡转化率均增大
C.升高温度通过降低活化能而加快化学反应速率
D.常温下,反应C(s)+CO2(g) === 2CO(g)不能自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
下列与化学反应能量变化相关的叙述正确的是
A.2CH3CH2OH(l)+6O2(g)===4CO2(g)+6H2O(l) ΔH=-1367kJ/mol,可见乙醇燃烧热ΔH=-1367 kJ/mol
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 中等查看答案及解析
-
下列说法正确的是
A.乳酸薄荷醇酯(
 )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应B.乙醛和丙烯醛(
 )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物C.淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
D.CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR来鉴别
难度: 中等查看答案及解析
-
恒温时,在一固定容积的容器内发生如下反应:2NO2(g)
N2O4(g)。达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡相比,NO2的体积分数
A.不变 B.增大 C.减小 D.无法判断
难度: 中等查看答案及解析
-
下列物质,既能和稀H2SO4溶液反应又能和NaOH溶液反应的是
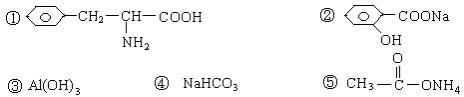
A.全部 B.仅①②③④ C.仅①④⑤ D.仅①②③
难度: 中等查看答案及解析
-
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
难度: 中等查看答案及解析
-
β—月桂烯的结构如图所示:
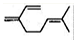
该物质与溴1:1发生加成反应的产物(不考虑顺反异构)理论上最多有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列实验不能达到实验目的的是
①实验窒用无水乙醇和浓硫酸共热到140℃即可制取乙烯
②验证R—X是碘代烷,把R—X与NaOH水溶液混合加热,再往其中加入硝酸银溶液即可
③做醛的还原性实验,向乙醛溶液中加入新制的Cu(OH)2悬浊液即可得到红色沉淀
④检验淀粉已水解,将淀粉与水和稀硫酸加热一段时间后,加入银氨溶液即可
⑤实验室制备乙酸乙酯,把乙醇和乙酸及稀硫酸溶液共热即可
A.①②③④⑤ B.①③④ C.①②③⑤ D.②③⑤
难度: 中等查看答案及解析
-
一定温度下,将1molM和1molN气体充入2L恒容密闭容器,发生反应M(g)+ N(g)
xP(g)+Q(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体P的浓度随时间变化如图所示。
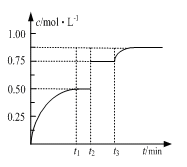
下列说法正确的是
A.反应方程式中的x=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质Q
D.t1~t3间该反应的平衡常数均为4
难度: 中等查看答案及解析
-
在实验室中,下列除去杂质的方法正确的是
①乙烷中混乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏;
⑤溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴;
⑥硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置后再过滤。
A.①②③⑥ B.②④ C.②③④ D.②③④⑥
难度: 中等查看答案及解析
-
以下物质;① 甲烷;② 苯;③ 聚乙烯;④ 聚乙炔;⑤ 2-丁炔;⑥ 环己烷;⑦ 邻二甲苯;⑧ 苯乙烯。既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
难度: 中等查看答案及解析
-
下列化合物中同分异构体数目最少的是
A.己烷 B.戊醇 C.戊烯 D.乙酸乙酯
难度: 中等查看答案及解析
-
在10L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
M(g)+N(g),所得实验数据如下表:
实验
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.40
0.10
0.090
②
800
0.10
0.40
0.080
③
800
0.20
0.30
a
④
900
0.10
0.15
b
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
难度: 中等查看答案及解析
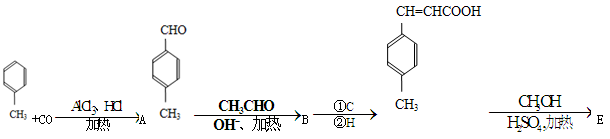
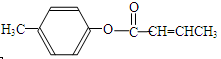 是E一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________________。
是E一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________________。