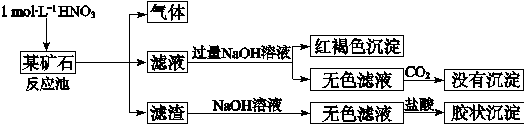
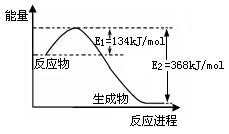
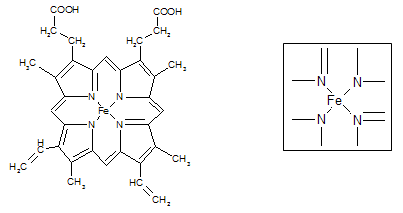
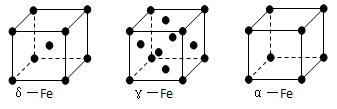
-
下列物质常温下为液态,且不溶于水密度比水大的有机物是( )
A.苯 B.一氯甲烷 C. 乙酸 D.溴苯
难度: 简单查看答案及解析
-
下列说法中,不正确的是( )
①同一元素的不同核素互称为同位素
②化学键可以使离子相结合,也可以使原子相结合
③金属腐蚀的实质是金属原子失去电子被还原的过程
④Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关
⑤蓄电池在放电过程中,负极质量减少,正极质量增加
⑥Al和Fe在一定条件下都能与某些氧化物反应
⑦干冰和氨都属于弱电解质
⑧汽油和花生油的主要成份都是油脂
A.①③④⑦⑧ B.②③④⑤⑧ C. ③④⑤⑦⑧ D.①③⑤⑥⑦
难度: 简单查看答案及解析
-
KNO3和NaCl的溶解度曲线如图所示。下列说法正确的是
A.40℃时,将35 g NaCl溶于100 g水中,降温至0℃时,可析出晶体
B.20℃饱和KNO3溶液的溶质质量分数>31.6%
C.a点KNO3和NaCl溶液的物质的量浓度相等
D.固体KNO3中混有NaCl,可用重结晶进行提纯
难度: 简单查看答案及解析
-
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是( )
A.X能形成化学式为X(OH)3的碱
B.X能形成化学式为NaXO3的含氧酸钠盐
C.X原子的最外层电子数和核电荷数不可能为偶数
D.X能与某些金属元素或非金属元素形成化合物
难度: 简单查看答案及解析
-
下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.H+、Fe2+、Cr2O72-、SO42- B.Al3+、Na+、SO42-、HCO3-
C.Na+、Cu2+、Cl-、S2- D.Fe3+、K+、SCN-、Cl-
难度: 简单查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:
c (Na+)>c(Cl-)>c(CH3COOH)
B.相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的c(H+):①>②>③
C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③
D.0.1mol/L醋酸钡溶液中,c (Ba2+)>c(CH3COO-)>c(OH-)> c (H+)
难度: 简单查看答案及解析
-
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3):n(CuSO4)=1:9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是( )
A.a电极与电源的负极相连
B.t2时,两电极的质量相差3.84 g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH-一4e-=2H2O+O2↑
难度: 简单查看答案及解析