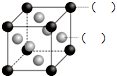
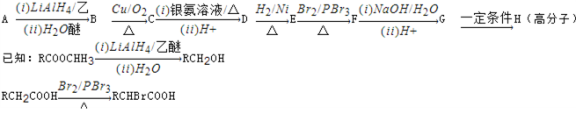-
化学与社会、生产、生活密切相关。下列说法正确的是
A.气象环境报告中的“PM2.5”是对一种新分子的描述
B.长期使用硫酸铵(NH4)2SO4化肥会使土壤酸化
C.“玉兔号”月球车太阳能电池帆板的材料是二氧化硅
D.高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应
难度: 简单查看答案及解析
-
在下列物质分类中,前者包含后者的是( )
A.氧化物、化合物
B.化合物、电解质
C.溶液、胶体
D.溶液、分散系
难度: 简单查看答案及解析
-
25℃和1.01×105Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )
A.是吸热反应
B.是放热反应
C.是熵减少的反应
D.熵增大效应大于能量效应
难度: 简单查看答案及解析
-
下列反应中.水只作还原剂的是
A.CaO+H 2 O=Ca(OH)2
B.C+H 2 O=CO+H 2
C.2F 2 +2H 2 O=4HF+O 2
D.3NO 2 +H 2 O=2HNO 3 +NO
难度: 简单查看答案及解析
-
如图是氢氧燃料电池构造示意图.关于该电池的说法不正确的是( )
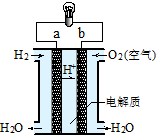
A.b极是正极
B.负极的电极反应式为: O2+2H2O+4e-=4OH-
C.电子由a通过灯泡流向b
D.氢氧燃料电池是环保电池
难度: 简单查看答案及解析
-
在国际环境问题中,使用一次性聚苯乙烯材料带来的“白色污染”极为严重,因为这种材料难分解,处理麻烦.最近科学家研制出了一种新材料
能代替聚苯乙烯,它是由乳酸(一种有机羟基羧酸)缩聚而成,能在乳酸菌的作用下降解而消除对环境的污染.下列关于聚乳酸的说法正确的是( )
A.聚乳酸是一种纯净物
B.聚乳酸是一种羧酸
C.聚乳酸的单体是
D.其聚合方式与聚苯乙烯的聚合方式相同
难度: 中等查看答案及解析
-
氟烷麻醉作用比吗啡强100倍,已知氟烷的化学式为C2HClBrF3,则沸点不同的上述氟烷有( )
A.4种 B.3种 C.2种 D.1种
难度: 简单查看答案及解析
-
下列物质性质与应用对应关系正确的是( )
A. 二氧化锰具有还原性,可用于实验室制备氯气
B. Na2O2能与水或二氧化碳反应生成氧气,可用作供氧剂
C. 碳酸氢钠能与碱反应,可用作食品的膨松剂
D. SO2具有漂白性,可用标准KMnO4溶液滴定食品中SO2残留量
难度: 简单查看答案及解析
-
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
难度: 简单查看答案及解析
-
下列有关实验误差分析中,不正确的是( )
A. 用湿润的pH试纸测稀碱液的pH值,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内有气泡,终点读数时无气泡,所测体积偏大
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
难度: 简单查看答案及解析
-
在恒容的密闭容器中,通过下列反应可实现燃煤烟气中硫的回收:SO2(g)+2CO(g)
2CO2(g)+S(l)△H<0,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应平衡常数不变
难度: 简单查看答案及解析
-
下列说法正确的是( )
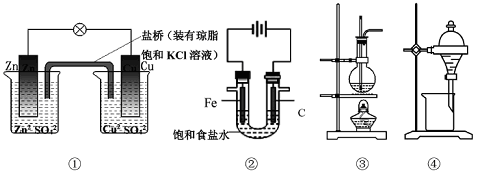
A. 图①铜锌原电池工作时,盐桥中的K+移向ZnSO4溶液
B. 图②装置反应一段时间,将湿润的KI淀粉试纸靠近碳电极管口,试纸变蓝
C. 图③是用海水制取蒸馏水的装置
D. 图④装置可用于乙醇提取碘水中的碘
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的数值,下列说法中正确的是( )
A.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
B.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后得到NH3分子数为NA
C.1.0L的0.1 mol•L-1Na2S溶液中含有的S2-离子数为0.1NA
D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO3-
B.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O
C.NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-
D.10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓
难度: 简单查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(g)△H1
3H2(g)+Fe2O3(s)=2Fe(s)+3H2O(g)△H2
2Fe(s)+
O2(g)=Fe2O3(s)△H3
2Al(s)+
O2(g)=Al2O3(s)△H4
2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是( )
A.△H1<0,△H3>0
B.△H5<0,△H4<△H3
C.△H1=△H2+△H3
D.△H3=△H4+△H5
难度: 简单查看答案及解析
-
室温下,向a点(pH=a)的20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
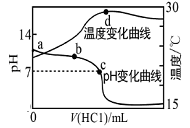
A.将此氨水稀释,溶液的导电能力减弱
B.b点溶液中离子浓度大小可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c点时消耗盐酸体积V(HCl)<20.00mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
难度: 简单查看答案及解析