-
硫单质及其化合物在工农业生产中有着吸要的应用.
(l)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g)的△H= _________;
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料.已知As2S3和HNO3有如下反应:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O.当生成H3AsO4的物质的量为0.6mol,反应中转移电子的数目为_________。
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS-、S2-的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出),滴加过程中,溶液中微位浓度大小关系正确的是_________ (填字母)。
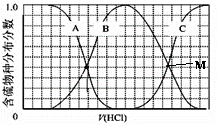
A.c(Na+)=c(H2S)+c(HS-)+2c(S2-)
B.2c(Na+)=c(H2S)+c(HS-)+c(S2-)
C.c(Na+)=3[c(H2S)+c(HS-)+c(S2-)]
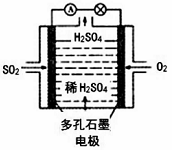
(4)某学习小组以SO2为原料,采用电化学方法制取硫酸。该小组设计的原电池原理如图2所示.写出该电池负极的电极反应式_________;
(5)难溶物ZnS遇CuSO4认溶液会慢慢转化为铜蓝(CuS)。若转化后溶液中c(Zn2+)=3.0×10-2mol•L-1,则c(Cu2+)= _________ mol•L-1〔已知Ksp(CuS)=1.0×10-36,Ksp(ZnS)=1.0×10-24
-
已知下列反应:
①2SO2(g)+O2(g) 2SO3(g);ΔH=
2SO3(g);ΔH= 196.6kJ•mol-1
196.6kJ•mol-1
②4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0
4NO(g)+6H2O(g);ΔH<0
③N2(g)+3H2(g) 2NH3(g);ΔH=
2NH3(g);ΔH= 92.4 kJ•mol-1
92.4 kJ•mol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量_______________(填“<”“>”“=”)98.3kJ;理由是___________________________;
(2)反应②的化学平衡常数表达式K=_________________________,温度降低时,K值_________________________(填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率=___________;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有____________________。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
-
雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-
2SO3(g) ΔH=- 196.6 kJ·mol -1
196.6 kJ·mol -1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)下图是一种用NH3脱除烟气中NO的原理。

①该脱硝原理中,NO最终转化为H2O和_____________(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式:_______________。
-
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g) △H=一akJ/mol
O2(g)+2SO2(g) 2S03(g) △H=-bkJ/mol
2S03(g) △H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。
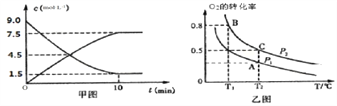
②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______ (用 K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2 Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,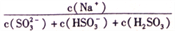 =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
-
(12分)硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
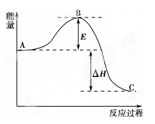
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_________,E的大小对该反应的反应热有无影响?___________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
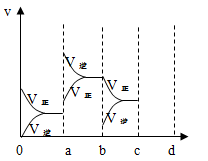
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
-
(12分)硫及其化合物在工业生产中有重要的应用,它们性质的研究对工业生产有重要的指导意义。
(1)2SO2(g)+O2(g) 2SO3(g),反应过程的能量变化如图所示。
2SO3(g),反应过程的能量变化如图所示。
已知1 mol SO2(g)氧化为1 mol SO3(g)放出的热量为99 kJ。请回答下列问题:
①图中E表示_____________,E的大小对该反应的反应热有无影响?_______________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____________,理由是_____________;
②图中ΔH=____________kJ·mol-1;
(2)下图表示在密闭容器中反应2SO2+O2 2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
2SO3 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况。
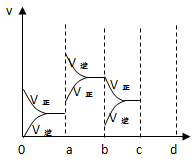
①a b过程中改变的条件可能是 ;
②b c过程中改变的条件可能是 ;
③若增大压强时,反应速率变化情况画在c~d处。
-
硫及其化合物对人类的生产和生活有着重要的作用.
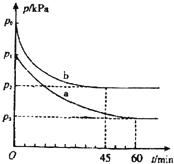
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣198kJ•mol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=﹣42kJ•mol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| | N(SO2) | N(NO2) | N(NO) |
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .
-
硫及其化合物对人类的生产和生活有着重要的作用.
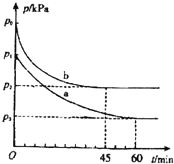
2SO2(g)+O2(g)⇌2SO3(g)△H=﹣198kJ•mol﹣1是制备硫酸的重要反应.
(1)在容积为V L的密闭容器中起始充入2mol SO2和1mol O2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示.与实验a相比,实验b改变的条件是 ,判断的依据 .
(2)二氧化硫在一定条件下还可以发生如下反应:
SO2(g)+NO2(g)⇌SO3(g)+NO(g)△H=﹣42kJ•mol﹣1.
在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| | N(SO2) | N(NO2) | N(NO) |
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)= ,该温度下的平衡常数 .
②实验丙中,达到平衡时,NO2的转化率为 .
③由表中数据可推知,Tl T2(填“>”“<’’或“=”),判断的理由是 .
-
(10分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义.
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
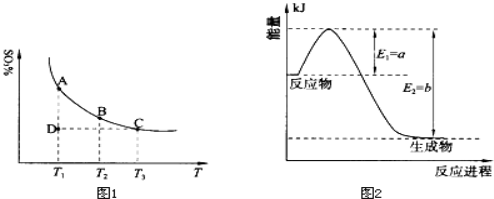
①恒温、恒压条件下,反应2SO2(g)+O2(g) 2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
2SO3(g)达平衡,向体系中通入氦气,平衡 移动(填“向左”、“向右”或“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”或“=”,下同);若反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①上图2是一定的温度和压强下是N2和H2反应生成1molNH3过程中能量变化示意图,请写出工业合成氨的热化学反应方程式: .(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水.在25℃下,将a mol•L-1的氨水与b mol•L-1的盐酸等体积混合,反应后溶液恰好显中性,用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)已知25°C时Ksp[AgCl]=1.6×10-10mol2•L-2,Ksp[AgI]=1.5×10-16mol2•L-2),在25℃下,向0.1L0.002mol•L-1的NaCl溶液中逐滴加入0.1L0.002mol•L-1硝酸银溶液,有白色沉淀生成.从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1L0.002mol•L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
-
运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义
(1)硫酸生产中,SO2催化氧化生成SO3; 2SO2(g)+O2(g) 2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
2SO3(g),平衡时,混合体系中SO3的百分含量和温度的关系如下图所示。根据图示回答下列问题:
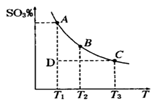
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)。
2SO3(g)的△H 0(填“>”或“<”):若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不移动”)。
②若温度为T1、T2,反应的平衡常数分别为K1,K2,则K1 K2;温度为T1时,反应进行到状态D时,
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用:
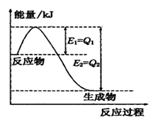
①如右图是一定的温度和压强下N2(g)和H2(g)反应生成lmol NH3(g)过程中能量变化示意图,图中E1、E2分别表示的意义是 、 。
②请写出工业合成氨的热化学方程式: (△H的数值用含字母Q1、Q2的代数式表示)
(3)SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)===SF6(g)的反应热ΔH为__________________。




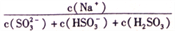 =______________。
=______________。






