-
化学与生产、生活、社会密切相关,下列有关说法正确的是
A. 古有“青蒿一握,以水二升渍,绞取汁”,今用乙醚从黄花蒿中可提取青蒿素是利用氧化还原反应原理
B. 食用“地沟油”对人体危害很大,但可以通过蒸馏的方式获得汽油、柴油等,实现资源的再利用。
C. 牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应
D. CO2是大量使用的灭火剂,但着火的镁条在CO2中继续燃烧说明它也可以助燃
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A. 常温下,0.1mol·L-1的碳酸钠溶液中含有的阴离子数大于0.1NA
B. 常温常压下,28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个
C. 标况下33.6mL氯气通入足量水中发生反应,转移电子数为1.5×10-3NA
D. 同温下,pH=1体积为IL的硫酸溶液所含氢离子数与pH=13体积为1L的氢氧化钠溶液所含氢氧根离子数均为0.1NA
难度: 困难查看答案及解析
-
分子式为C5H10O2且能与NaOH溶液反应的有机物有(不含立体异构)
A. 4种 B. 9种 C. 13种 D. 16种
难度: 困难查看答案及解析
-
下列操作及解释都正确的是
选项
应用
解释
A
在相同条件下,在两支试管中各加入2mL5% H2O2溶液,再向H2O2溶液中分别滴入1mLH2O和lmL0.lmol/LFeCl3溶液,对比观察现象
可以探究催化剂FeCl3对H2O2分解速率的影响
B
向盛有1mL0.0lmol/LAgNO3溶液的试管中滴加5滴0.01mol/LNaCl溶液,有白色沉淀生成,再向其中滴加0.0lmol/LKI溶液,产生黄色沉淀。
常温下,Ksp(AgCl>Ksp(AgI)
C
向两份蛋白溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出
蛋白质均发生变性
D
保存硫酸亚铁溶液需加入少量稀盐酸和铁钉
防止Fe2+水解以及被O2氧化
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
近年来AIST报告正在研制一种“高容量、低成本”的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH一,下列说法不正确的是 ( )

A. 放电时,Li+透过固体电解质向Cu极移
B. 放电时,正极的电极反应式为O2+2H2O+4e一=4OH—
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 通空气时,整个反应过程中,铜相当于是催化剂
难度: 困难查看答案及解析
-
X、Y、Z、M、 W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见的大气污染气体甲。X, Y, Z三种元素形成化合物乙。下列说法错误的是
A. 气体甲可与Z的某种氢化物反应生成强酸
B. W元素的晶体单质是一种良好的半导体材料
C. 化合物乙中一定只有共价键
D. X分别与Y、 Z、M、 W形成的常见化合物中,稳定性最好的是XM
难度: 简单查看答案及解析
-
25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]-Ksp[Fe(OH)2],下列说法正确的是

A. b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1
B. 当Fe(OH)2 和Cu(OH)2沉淀共存时,溶液中:C(Fe2+):c(Cu2+)= l:104.6
C. 向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液
D. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
难度: 困难查看答案及解析


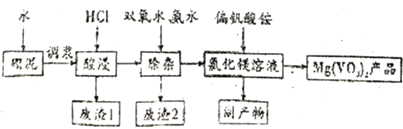
 ,X表示显色剂,
,X表示显色剂,




 写出由C制备
写出由C制备 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: _____________________
_____________________