-
关于Na2CO3和NaHCO3的比较中,下列说法不正确的是
A.NaHCO3固体受热容易分解,而Na2CO3固体受热不容易分解
B.等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,前者消耗盐酸的物质的量比后者多
C.向等物质的量浓度的Na2CO3和NaHCO3溶液分别滴加2滴酚酞溶液,前者颜色比后者深
D.Na2CO3溶液和NaHCO3溶液分别与Ba(OH)2溶液反应的离子方程式相同
难度: 中等查看答案及解析
-
下列说法不正确的是
A.汽车尾气中有NOx,主要是汽油不充分燃烧引起的
B.日用铝制品表面覆盖着氧化膜,对金属起保护作用
C.实验室常用粗锌和稀硫酸反应制取H2
D.从海水中提取溴的过程涉及氧化还原反应
难度: 简单查看答案及解析
-
钠着火后,可用于灭火的物质或器材是
A.水 B.泡沫灭火器 C.干冰灭火剂 D.干砂
难度: 简单查看答案及解析
-
下列有关物质的分类全部正确的一组是
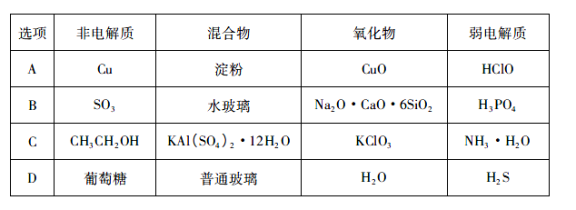
难度: 中等查看答案及解析
-
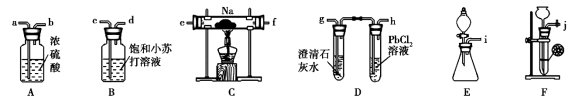
利用下列实验装置能完成对应实验的是
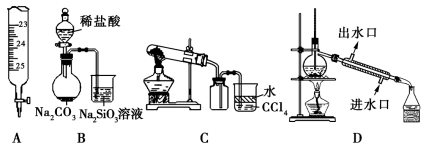
A.量取20.00 mL Na2CO3溶液 B.能证明非金属性 Cl>C>Si
C.实验室制取并收集NH3 D.分离酒精与CCl4
难度: 中等查看答案及解析
-
下列说法不正确的是
A.Si与SiO2在常温下都可与NaOH溶液反应
B.C与SiO2之间可以反应制备Si,同时得到CO
C.Si与SiO2都可以与氢氟酸反应
D.Si→SiO2→H2SiO3可以通过一步反应实现
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是
A.1 mol OH-中含有9NA个电子
B.常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子
C.1 L 1 mol/L AlCl3溶液中含有NA个Al3+
D.常温常压下,11.2 L甲烷气体中含有的分子数为0.5NA
难度: 中等查看答案及解析
-
Na2O2、HCl、Al2O3 三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-;且溶液呈
中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
A.3:2:1 B.2:4:1 C.2:3:1 D.4:2:1
难度: 中等查看答案及解析
-
a mol Na2O2和b mol NaHCO3固体混合后,在密闭容器中加热到250 ℃,使其充分反应,当排出O2和H2O(g)的物质的量之比为1∶1 时,a∶b为
A.1∶1 B.1∶2 C.2∶3 D.2∶1
难度: 中等查看答案及解析
-
下列有关除杂的实验操作合理的是
A.用加入过量氨水并过滤的方法除去NaCl溶液中混有的AlCl3
B.除去NaCl溶液中少量的Na2S:加入AgCl后再过滤
C.向MgCl2溶液中加入CaCO3粉末,充分搅拌后过滤可除去杂质FeCl3
D.除去FeCl3溶液中少量的CuCl2:加入足量铁粉,过滤
难度: 中等查看答案及解析
-
海带中提取碘的实验方法:①称取3 g干海带,用刷子把干海带表面的附着物刷净;②将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中;③用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却;④将海带灰转移到小烧杯中,再向烧杯中加入10 mL蒸馏水,搅拌,煮沸2~3 min,使可溶物溶解,过滤;⑤向滤液中滴入几滴硫酸,再加入约1 mL H2O2溶液,观察现象。下列说法正确的是
A.步骤①中也可以用水洗涤除去海带表面的附着物
B.步骤④过滤操作需要两种玻璃仪器
C
.步骤⑤所得的溶液中加入淀粉可看到溶液变为蓝色
D.通过以上①~⑤步骤即可得到纯度高的I2
难度: 困难查看答案及解析
-
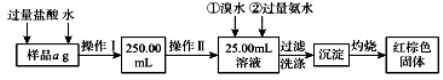
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如图所示,其中不正确的是

A.溴在周期表中位于第四周期第ⅦA族
B.步骤③说明溴具有挥发性
C.步骤④的离子方程式为Br2+SO2+H2O
2H++2Br-+S
D.步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离
难度: 中等查看答案及解析
-
在如图所示的物质转化关系中,A是一种常见的单质,B、C为常见的化合物,A、B、C中均含有元素X。下列判断不正确的是
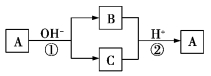
A.X元素可能为硫或碘等 B.A可能为金属单质或非金属单质
C.B、C可能是两种不同类型的盐 D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用CCl4萃取碘水中的I2时,有机层从分液漏斗的上口倒出
B. 某集气瓶内气体呈红棕色,则内充气体中一定有NO2
C. 能使品红溶液褪色的气体一定是SO2
D. 加入NaOH溶液,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH4+
难度: 简单查看答案及解析
-
某溶液中含如下离子组中的若干种:K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是
A.原溶液中肯定不含Fe2+、N、Si、I-
B.步骤Ⅱ中无色气体是NO气体,无CO2气体产生
C.原溶液中肯定含有K+、Fe3+、Fe2+、N、S
D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
难度: 困难查看答案及解析
-
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是
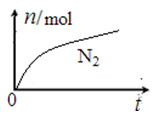
A.该反应的还原剂是Cl-
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
难度: 中等查看答案及解析
-
10克Fe2O3、SiO2、Al2O3混合物加入足量的100 mL x mol/L稀硫酸中,过滤,然后加入10 mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积如下图。以下叙述错误的是
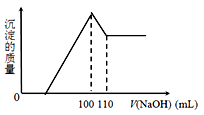
A.滤出的物质为SiO2
B.可求出x的值
C.可求出Al2O3的质量分数
D.可求出Fe2O3的质量分数
难度: 困难查看答案及解析
-
已知3.25 g某金属X与过量稀硝酸反应,在反应过程中未见有气体生成,反应后在所得溶液中加入热碱溶液可放出一种气体,其体积为280 mL(标准状况),则X为
A.Zn B.Fe C.Cu D.Ag
难度: 中等查看答案及解析
-
下列评价及离子方程式书写正确的是
选项
离子组
评价
A
H+、Fe2+、NO3—、Cl—
不能大量共存于同一溶液中,因为发生了氧化还原反应
4Fe2++NO3—+6H+=4Fe3++2NO↑+3H2O
B
Na+、CO32—、Cl—、Al3+
不能大量共存于同一溶液中,因为发生了互促水解反应
2Al3++3CO32—+3H2O=2Al(OH)3↓+3CO2↑
C
Fe3+、K+、SCN—、Br—
不能大量共存于同一溶液中,因为有红色沉淀生成
Fe3++3SCN—===Fe(SCN)3↓
D
HCO3—、OH—、Na+、Ca2+
不能大量共存于同一溶液中,因为发生如下反应
HCO3—+OH—===CO2↑+H2O
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液中:K+、Cu2+、OH-、Na+
B.含有大量Fe3+的溶液:Na+、Mg2+、NO3﹣、SCN﹣
C.pH=12的溶液中:K+、NH4+、SO42﹣、NO3﹣
D.水电离产生的c(OH﹣)=1×10﹣14mol•L﹣1:K+、Na+、Cl﹣、NO3﹣
难度: 中等查看答案及解析