-
过碳酸钠(2Na2CO3·3H2O2 )是由Na2CO3-与H2O2复合而形成的一种固体放氧剂,可用于洗涤、纺织、医药、卫生等领域。工业上常以过碳酸钠产品中活性氧含量 来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如下:
来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如下:

回答下列问题:
(1)过碳酸钠受热易分解,写出反应的化学方程式 。
(2)稳定剂及反应温度等因素对产品质量有很大影响。
①下列试剂中,可能用作“稳定剂”的是 (填字母)。
a. MnO2 b. KI c. Na2SiO3 d. FeC13
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示。要使产品达到优等品且产率超过90%合适的反应温度范围是 。

③“结晶”时加入NaCl的目的是 ,其作用原理是 。
(3)“母液”中可循环利用的主要物质是 。
(4)产品中活性氧含量的测定方法:称量0.1600 g样品,在250 mL锥形瓶中用100 mL 0.5mol · L-1硫酸溶解完全,立即用0.02000 mol · L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56 mL ;另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有 。
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响及其原因 。
③该样品的活性氧含量为 %,表明该样品 (填“是”或“不是”)
-
氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
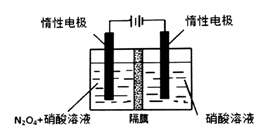
(l)从N2O5可通过电解或臭氧氧化N2O4的方法制备。电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为 。
己知:2NO(g)+O2(g)=2NO2(g) △H1
NO(g)+O3(g)=NO2(g)+O2(g) △H2
2NO2(g) N2O4(g) △H3
N2O4(g) △H3
2N2O5(g)=4NO2(g)+O2(g) △H4
则反应N2O4(g)+O3(g)=N2O5(g)+O2(g)的△H= 。
(2)从N2O5在一定条件下发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

设反应开始时体系压强为P0,第2.00 min时体系压强为p,则p:p0= ;1.00一3.00min内,O2的平均反应速率为 。
(3)从N2O4与NO2之间存在反应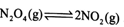 。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
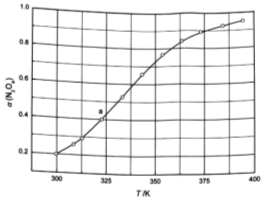
①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测 是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
③对于反应 ,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:
,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系: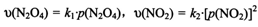 。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
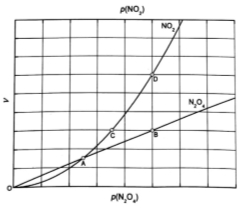
一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由 。
-
工业生产玻璃会产生大量的窑炉气(含SO2和氮氧化物等)。为减少环境污染,某工厂生产玻璃与处理窑炉气的工艺流程如下:

(l)生产普通硅酸盐玻璃的主要原料是石英砂、 和石灰石。其中,石灰石参与的反应方程式是 。
(2)窑炉气中的SO2一部分来源于原料中添加剂Na2SO4的热分解,该反应方程式为 ;氮氧化物主要源于空气中N2与O2的反应,该类气体在高温下基本无色,随温度的降低逐渐偏向红棕色,原因是 。
(3)“脱硫塔”中反应形成的灰分,除亚硫酸钠和氮的含氧酸盐外,主要还有 ;用于喷雾的火碱溶液应选用软化水配制,原因是 。
(4)在“脱硝装置”中,催化剂设计成蜂窝而韭平板状结构.原因是 。氧气在脱硝过程中的作用是 。
(5)净化气的主要成分是 。
-
倍半硅氧烷在液晶显示、塑料阻燃、生物医用等领域具有重要应用,氢基倍半硅氧烷的分子结构如图A所示,其加热分解产物中SiO2的晶胞结构如图B所示,回答下列问题:

(1)基态Si原子的最外层电子排布式为______,其中成对电子之间的主要区别是______
(2)图A分子中H的化合价为______,Si原子采用_____杂化,形成的极性共价键类型为______;键的极性Si-H键______Si-O(填空“>”、“<”、“=”)
(3)图A分子结构中,一个硅原子被3个____元环共有,硅的配位数为____,该分子的分子式为____
(4)氢基倍半硅氧烷为___晶体,SiO2为____晶体;
(5)每个SiO2晶胞含有Si原子的个数为____;已知SiO2晶体为面心立体结构,晶胞参为a nm,阿伏加德罗常数的值为NA,则SiO2晶体的密度为____g·cm-3
-
中国科学家屠呦呦因青蒿素的研究荣获了2015年诺贝尔奖。由青蒿素合成系列衍生物(它们的名称和代号如图所示)的路线如下:

己知氢化青蒿素的分子式为C15H22O4。回答下列问题:
(l)青蒿素的分子式为 。
(2)反应①中,NaBH4的作用是 。
A.氧化剂 B.还原剂 C.催化刑 D.溶剂
(3)有机物D的结构简式为 。
(4)青蒿琥酯能够发生的反应类型有 。
A.酷化反应 B.水解反应 C.还原反应 D.加聚反应
(5)参照H2Q的表示方式,写出反应②的化学方程式 。
(6)从双氢青蒿素(H2Q)出发,可通过多步反应合成出有机物E。合成过程中,有机原料除H2Q、 外,还需含苯环的二羟基化合物P,其结构简式为 。化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 。
外,还需含苯环的二羟基化合物P,其结构简式为 。化合物S是P的同分异构体,其分子结构含有苯环,有4种不同类型的氢,且个数比为3:2:2:1,写出S的一种结构简式 。








 来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如下:
来衡量其优劣,13%以上为优等品。一种制备过碳酸钠的工艺流程如下:



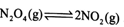 。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
 是吸热反应还是放热反应,说明理由
是吸热反应还是放热反应,说明理由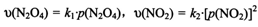 。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:



 外,还需含苯环的二羟基化合物P,其结构简式为
外,还需含苯环的二羟基化合物P,其结构简式为