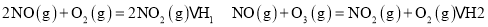-
氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化。
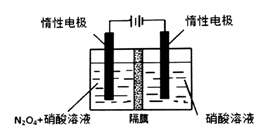
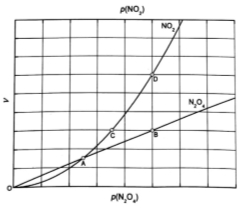
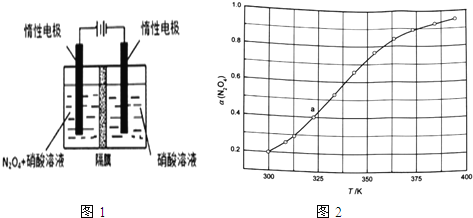
(l)从N2O5可通过电解或臭氧氧化N2O4的方法制备。电解装置如图所示(隔膜用于阻止水分子通过),其阳极反应式为 。
己知:2NO(g)+O2(g)=2NO2(g) △H1
NO(g)+O3(g)=NO2(g)+O2(g) △H2
2NO2(g) N2O4(g) △H3
N2O4(g) △H3
2N2O5(g)=4NO2(g)+O2(g) △H4
则反应N2O4(g)+O3(g)=N2O5(g)+O2(g)的△H= 。
(2)从N2O5在一定条件下发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:

设反应开始时体系压强为P0,第2.00 min时体系压强为p,则p:p0= ;1.00一3.00min内,O2的平均反应速率为 。
(3)从N2O4与NO2之间存在反应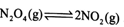 。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
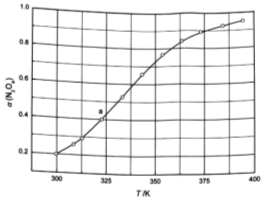
①图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,列式计算该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②由图推测 是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
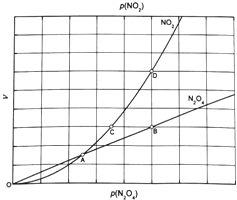
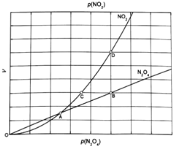
③对于反应 ,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:
,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系: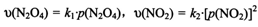 。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
一定温度下,kl、k2与平衡常数Kp的关系是kl= ,在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由 。
-
氮的氧化物(如NO2、NO4、N2O5等)应用很广,在一定条件下可以相互转化.
(1)从N2O5可通过电解或臭氧氧化N2O4的方法制备.电解装置如图1所示(隔膜用于阻止水分子通过),其阳极反应式为___ .
己知:2NO(g)+O2(g)═2NO2(g)△H1
NO(g)+O3(g)═NO2(g)+O2(g)△H2
2NO2(g)⇌N2O4(g)△H3
2N2O5(g)═4NO2(g)+O2(g)△H4
则反应N2O4(g)+O3(g)═N2O5(g)+O2(g)的△H=___ .
(2)从N2O5在一定条件下发生分【解析】
2N2O5(g)═4NO2(g)+O2(g).某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/mol/L | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0 , 第2.00min时体系压强为p,则p:p0=___ ;1.00~3.00min内,O2的平均反应速率为___ .
(3)从N2O4与NO2之间存在反应N2O4⇌2NO2(g).将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图1所示.
①图中a点对应温度下,已知N2O4的起始压强p0为108kPa,列式计算该温度下反应的平衡常数Kp=___ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
②由图推测N2O4(g)⇌2NO2(g)是吸热反应还是放热反应,说明理由___ ,若要提高N2O4转化率,除改变反应温度外,其他措施有___ (要求写出两条).
③对于反应N2O4(g)⇌2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1•p(N2O4),v(NO2)=k2[p(NO2)]2 . 其中,kl、k2是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,kl、k2与平衡常数Kp的关系是kl=___ ,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___ .
-
氮的氧化物 如
如 、
、 、
、 等
等 应用很广,在一定条件下可以相互转化.
应用很广,在一定条件下可以相互转化.
(1)从 可通过电解或臭氧氧化
可通过电解或臭氧氧化 的方法制备.电解装置如图1所示
的方法制备.电解装置如图1所示 隔膜用于阻止水分子通过
隔膜用于阻止水分子通过 ,其阳极反应式为______.
,其阳极反应式为______.
已知: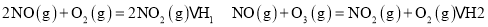


则反应 的
的 ______.
______.
(2)从 在一定条件下发生分【解析】
在一定条件下发生分【解析】
 某温度下测得恒容密闭容器中
某温度下测得恒容密闭容器中 浓度随时间的变化如下表:
浓度随时间的变化如下表:
设反应开始时体系压强为 ,第
,第 时体系压强为p,则p:
时体系压强为p,则p: ______;
______; 内,
内, 的平均反应速率为______.
的平均反应速率为______.
(3)从 与
与 之间存在反应
之间存在反应 将一定量的
将一定量的 放入恒容密闭容器中,测得其平衡转化率
放入恒容密闭容器中,测得其平衡转化率 随温度变化如图1所示.
随温度变化如图1所示.
 图中a点对应温度下,已知
图中a点对应温度下,已知 的起始压强
的起始压强 为108kPa,列式计算该温度下反应的平衡常数
为108kPa,列式计算该温度下反应的平衡常数 ______
______ 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压 总压
总压 物质的量分数
物质的量分数 .
.
 由图推测
由图推测 是吸热反应还是放热反应,说明理由______,若要提高
是吸热反应还是放热反应,说明理由______,若要提高 转化率,除改变反应温度外,其他措施有______
转化率,除改变反应温度外,其他措施有______ 要求写出两条
要求写出两条 .
.
 对于反应
对于反应 ,在一定条件下
,在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: ,
, 其中,
其中, 、
、 是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下,
是与反应及温度有关的常数.相应的速率一压强关系如图所示:一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是 ______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
______,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由______.
-
氮有不同价态的氧化物,如NO、N2O3、NO2, N2O5等,它们在一定条件下可以相互转化。
(1)己知:2NO(g)+O2(g) =2NO2(g)△H1=-113kJ/mol
NO(g)+O3(g)=NO2(g)+O2(g) △H2=-199 kJ/mol
4NO (g)+O2(g) =2N2O5(g) △H4=-57 kJ/mol
则反应6NO2 (g)+O3(g)=3N2O5(g) △H=__________。
(2)某温度下.在一体积可变的密闭容器中充入1mol N2O3,发生反应N2O3 NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
NO2(g)+NO(g),达到平衡后,于t1时刻改变某一条件后,速率与时间的变化图像如图所示,有关说法正确的是__________
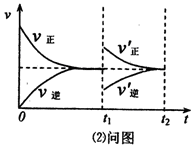
A.t1时刻改变的条件是增大N2O3的浓度,同时减小NO2或NO的浓度
B.t1时刻改变条件后,平衡向正反应方向移动,N2O3的转化率增大
C.在t2时刻达到新的平衡后,NO2的百分含量不变
D.若t1时刻将容器的体积缩小至原容积的一半,则速率~时间图像与上图相同
(3)在1000K下,在某恒容容器中发生下列反应:2NO2(g)  2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率α(NO2)随温度变化如图所示。图中a点对应温度下.己知NO2的起始压强P0为120kPa,列式计算该温度下反应的平衡常数Kp= __________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).

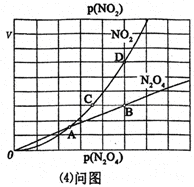
(4)对于反应N2O4(g) 2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
2NO2(g),在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2·p2 (NO2)。其中,k1、k2是与反应及温度有关的常数。相应的速率-压强关系如图所示:一定温度下,k1、k2与平衡常数Kp间的关系是k1=____________;在上图标出点中,指出能表示反应达到平衡状态的点__________,理由是__________。
-
某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是( )
A. N2O B. NO C. NO2 D. N2O5
-
某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为
1︰2的N2和CO2,该氧化物是( )
A. N2O B. NO C. NO2 D. N2O5
-
某氮的氧化物和CO在催化剂存在下充分反应,生成物质的量之比为1︰2的N2和CO2,该氧化物是( )
A. N2O B. NO C. NO2 D. N2O5
-
氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,他们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为___________。已知N2O与CO2分子具有相似的结构,试画出N2O的结构式_______。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。
已知:2NO2(g) N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2O4(g) △H =-akJ·mol-1;N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-bkJ·mol-1;
N2(g)+2O2(g)=2NO2(g) △H =+ckJ·mol-1;(a、b、c均大于0)。
写出气态腁在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式___________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如p(NO2)=p总×x(NO2))。写出反应2NO2(g) N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
N2O4(g) △H =-akJ·mol-1平衡常数Kp表达式________(用p总、各气体物质的量分数x表示)。
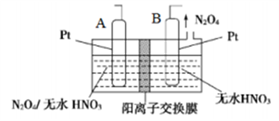
(4)新型绿色硝化剂N2O5可以N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的____极,电解池中生成N2O5的电极反应式为_____________。
(5)可用氨水吸收NO2、O2生成硝酸铵,写出该反应的离子方程式_____________。
已知25℃时NH3·H2O的电离常数Kb=2×10-5,向500ml0.1mol·L-1硝酸铵溶液中通入标准状况下至少____ml氨气,使溶液呈中性(溶液的体积变化忽略不计)。
-
氮可形成多种氧化物,如NO、NO2、N2O4等。
(1)电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是_____,理由是:_____________________________。

(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2‾)和c(CH3COO‾)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4 mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)100℃时,将0.400 mol 的NO2气体充入2L抽空的密闭容器中,发生反应2NO2(g) N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
N2O4(g) ∆H < 0。每隔一定时间就对该容器内的物质进行分析,得到如下表所示数据。
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0. 08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol/(L.min);n3 n4(填“>”、“<”或“=”),该反应的平衡常数的值为 。
②若在相同条件下,最初向该容器充入的是N2O4气体,达到上述同样的平衡状态,则N2O4的起始浓度是 mol/L;假设从放入N2O4到平衡时需要80s,则达到平衡时四氧化二氮的转化率为 。
-
臭氧的脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是
N2O5(g)+O2(g),一定条件下,向2.0 L恒容密闭容器中充入2.0 mol NO2和1.0 mol O3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是

A.反应2NO2(g)+O3(g) N2O5(g)+O2(g) △S<0
N2O5(g)+O2(g) △S<0
B.曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb
C.曲线b对应的条件改变可能是密闭容器的体积变为4.0 L
D.若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1

N2O4(g) △H3

 。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度变化如图所示。
 是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。
是吸热反应还是放热反应,说明理由 ,若要提高试N2O4,除改变反应温度外,其他措施有 (要求写出两条)。 ,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:
,在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系: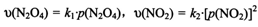 。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示:
。其中,kl、k2是与反应及温度有关的常数。相应的速率一压强关系如下图所示: