-
下列各式中属于正确的水解反应离子方程式的是( )
A. NH4+ + H2O ⇌ NH3•H2O + H+ B. S2- + 2H2O ⇌ H2S + 2OH-
C. CH3COOH + H2O ⇌ CH3COO- + H3O+ D. CH3COOH + OH- ⇌ CH3COO- + H2O
难度: 简单查看答案及解析
-
常温下将0.02 mol/L HCN溶液与0.02 mol/L NaCN溶液等体积混合,测得混合溶液的pH>7,则下列关系正确的是( )
A. c(Na+)>c(CN-)>c(OH-)>c(H+) B. c(HCN)+c(CN-)=0.04 mol/L
C. c(OH-)=c(H+)+c(HCN) D. c(CN-)>c(HCN)
难度: 中等查看答案及解析
-
下列应用与盐类的水解无关的是( )
A.纯碱溶液可去除油污
B.NaCl可用作防腐剂和调味剂
C.TiCl4溶于大量水加热制备TiO2
D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体
难度: 中等查看答案及解析
-
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4.3×10-7
K2=5.6×10-11
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(ClO-)>c(HCO3-)>c(H+)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3-)
D.c(Na+)+c(H++H)=c(HCO3-)+c(ClO-)+c(OH-)
难度: 困难查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是
A. pH=3的盐酸和pH=11的氨水等体积混合
B. pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
以下电离方程式书写正确的是( )
A. H2S
2H++S2- B. CaCO3=Ca2++CO32-
C. NaHCO3
Na++HCO3- D. NaHS=Na+ + H+ + S2-
难度: 简单查看答案及解析
-
下列事实中能说明亚硝酸是弱电解质的是( )
A. 用
溶液做导电试验,灯光较暗
B.
是共价化合物
C. 亚硝酸不与氯化钠反应
D. 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L
难度: 简单查看答案及解析
-
已知25℃,醋酸溶液中存在下述关系:K=
=1.75×10-5,则有关K的下列说法正确的是( )
A. 当向该溶液中加入一定量的硫酸时,K值增大 B. 升高温度,K值增大
C. 向醋酸溶液中加水,K增大 D. 向醋酸溶液中加氢氧化钠,K增大
难度: 中等查看答案及解析
-
下表是常温下某些一元弱酸的电离常数:
弱酸
HCN
HF
CH3COOH
HNO2
电离常数
6.2×10-10
6.8×10-4
1.7×10-5
6.4×10-6
则0.1 mol·L-1的下列溶液中,pH最小的是( )
A. HCN B. HF C. CH3COOH D. HNO2
难度: 简单查看答案及解析
-
已知299 K时,合成氨反应N2(g ) + 3H2 ( g )
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
难度: 简单查看答案及解析
-
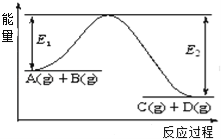
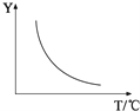
如图所示,可逆反应:2A(g)+B(g)
2C(g) △H<0的图像正确的是( )
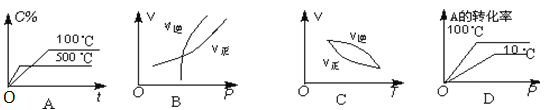
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设C(s)+CO2(g)
2CO(g) ΔH>0,反应速率为v1,N2(g)+3H2(g)
2NH3(g) ΔH<0,反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为( )
A. 同时增大 B. 同时减小
C. v1增大,v2减小 D. v1减小,v2增大
难度: 简单查看答案及解析
-
一定量的Fe与足量的0.5mol∕l盐酸反应,为了加快反应速率,但又不影响产生氢气的总量,应加入下列物质中的 ( )
A. NaNO 3 溶液 B. 将Fe改为用同质量的Na
C. 改为用同浓度的硫酸 D. CuSO 4 粉末
难度: 中等查看答案及解析
-
四位同学同时进行反应A+3B
2C+2D的速率测定实验,分别测得反应速率如下,其中反应进行得最快的是
A. V(A)=0.15mol·(L·s )-1 B. V(B)=0.6mol·(L·s)-1
C. V(C)=0.4mol·(L·s )-1 D. V(D)= 0.45mol·(L·s)-1
难度: 简单查看答案及解析
-
t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)
2Z(g),各组分在不同时刻的浓度如下表:
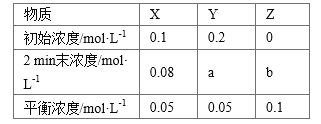
下列说法正确的是
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动
D. 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L-1·min-1
难度: 中等查看答案及解析
-
已知4NH3+5O2⇌4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A. 4vNH3)=5vO2) B. 6vO2)=5vH2O)
C. 4vNH3)=6vH2O) D. 5vO2)=4v(NO)
难度: 简单查看答案及解析
-
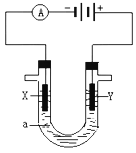
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼胶KNO3的U形管)构成一个原电池(如图)。下列有关该原电池的叙述中正确的是( )
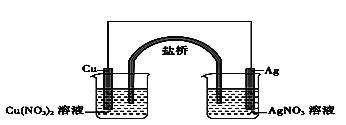
①在外电路中,电子由铜电极流向银电极
②正极反应:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B. ①②④ C. ②③ D. ①③④
难度: 困难查看答案及解析
-
关于镀铜和电解精炼铜,下列说法中正确的是( )
A. 都用粗铜作阳极、纯铜作阴极
B. 电解液的成分都保持不变
C. 阳极反应都只有Cu-2e-=Cu2+
D. 阴极反应都只有Cu2++2e-=Cu
难度: 中等查看答案及解析
-
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉).下列说法错误的是( )
A. 阴极附近溶液呈红色 B. 阴极逸出气体
C. 阳极附近溶液呈蓝色 D. 溶液的pH变小
难度: 困难查看答案及解析
-
下列热化学方程式表达正确的是(
的绝对值均正确)
A. C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g) △H=–1367.0 kJ/mol(燃烧热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) △H= +57.3kJ/mol(中和热)
C. S(s)+O2(g)=SO2(g) △H=–269.8kJ/mol (反应热)
D. 2NO2=O2+2NO △H= +116.2kJ/mol (反应热)
难度: 中等查看答案及解析