-
有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
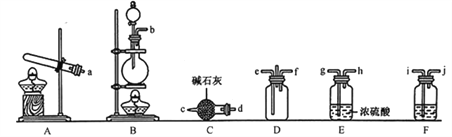
①利用装置A制取实验所需的氨气,写出反应的化学方程式:_______________________。
②该实验中用浓盐酸与MnO2反应制取所需氯气,则装罝F中的试剂是_______________(填写试剂名称)。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:________→-ef←_________(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要___________。
(2)岩脑砂中元素的测定:准确称取a g岩脑砂,与足量的氧化铜混合加热(发生的反应为:2NH4Cl+3CuO 3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
3Cu+N2↑+2HCl↑+3H2O),利用下列装置测定岩脑砂中氮元索和氯元素的质量之比。
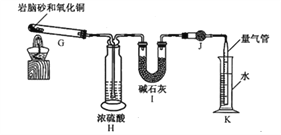
①设置装置H的目的是_____________。
②若装置Ⅰ增重b g,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5 L·mol-1),则岩脑砂中m(N):m(Cl)=_____________(用含b、V的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值_____________(填“偏高”“偏低”或“无影响”)。
-
缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq) H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g) CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l) H2CO3 (aq) △H2=bkJ • mol-1;
H2CO3 (aq) △H2=bkJ • mol-1;
HCO3-(aq) H+(aq)+CO32-(aq) △H3=ckJ • mol-1;
H+(aq)+CO32-(aq) △H3=ckJ • mol-1;
CO2(g)+H2O(l) 2H+(aq)+CO32-(aq) △H4=dkJ • mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ • mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则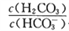 ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g) MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
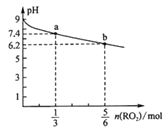
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
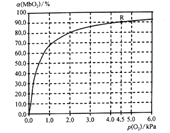
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
-
我国电池的年市场消费量约为80亿只,其中70%是锌锰干电池,利用废旧锌锰干电池制备硫酸锌晶体(ZnSO4·7H2O)和纯MnO2的工艺如下图所示:
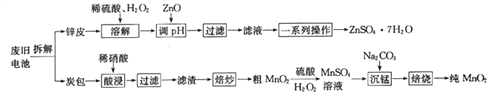
已知:
①锌皮的主要成分为Zn,含有少量Fe;炭包的主要成分为ZnCl2、NH4Cl、MnO2、碳粉等,还含有少量的 Cu、Ag、Fe 等。
②Ksp[Zn(OH)2]=2.0×10-16;Ksp[Fe(OH)2]=8.0×10-16;Ksp[Fe(OH)3]=4.0×10-38。
(1)除去炭包中碳粉的操作为_____________。
A.酸浸 B.过滤 C.焙炒 D.焙烧
(2)粗MnO2转化为MnSO4时,主要反应的离子方程式为_____________________。
(3)焙烧时发生反应的化学方程式为_____________。
(4)制备硫酸锌晶体流程中,用ZnO调节溶液pH的目的是______________________________,若溶解时不加H2O2带来的后果是____________________。
(5)“草酸钠-高锰酸钾返滴法”可测定MnO2的纯度:取agMnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1mLc1mol·L-1Na2C2O4溶液(足量),最后用c2mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达终点时消耗V2 mL标准KMnO4溶液。
①MnO2参与反应的离子方程式为_____________。
②该样品中MnO2的质量分数为__________________(假定杂质不参与反应,列出表达式即可)。
-
砷(As)可作为半导体村料锗(Ge)和硅的掺杂元素,这些材料广泛应用于发光二极管、红外线发射器等。回答下列问题:
(1)天然的SiO2存在形态有结晶形和无定形两大类,结晶形SiO2能自发的呈现规则多面体外形的性质被称为晶体的______________性,区分这两种形态的SiO2最可靠的方法足对固体进行___________实验。
(2)基态砷原子的价层电子排布图为_____________,最高能层符号为_____________,Ge、As、Se第一电离能从大到小的顺序为_____________________。
(3)锗元素与碳元素类似,可形成锗烷(GenH2n+2),但至今没有发现n大于5的锗烷,根据下表提供的数据分析其中的原因_____________________。
| 化学键 | C-C | C-H | Ge-Ge | Ge-H |
| 键能(kJ·mol-1) | 346 | 411 | 188 | 288 |
(4) GeCl4分子中的键角为_____________,GeH4分子中Ge的_____________轨道和H的_________轨道重叠形成σ键。
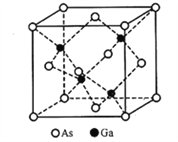
(5)立方砷化镓的晶胞如下图所示,已知晶胞边长为565pm,则Ga-As键的键长为___________pm(只列出算式即可),Ga-As键中共用电子对偏向____________(填“Ga”或“As”)。
-
化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去):
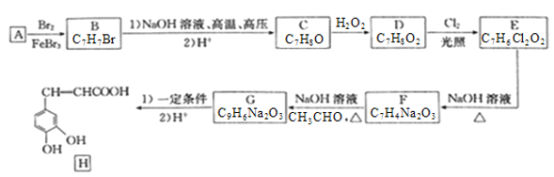
己知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③ ;
;
④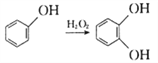 。
。
(1)有机物B的名称为___________________。
(2)由D生成E的反应类型为__________________,E中官能团的名称为__________________。
(3)由G生成H所需的“一定条件”为____________________。
(4)写出B与NaOH溶液在高温高压下反应的化学方程式:___________________________。
(5)F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:___________________。
(6)设计由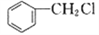 和丙醛合成
和丙醛合成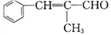 的流程图:_______________________ (其他试剂任选)。
的流程图:_______________________ (其他试剂任选)。
)和香茅醇(
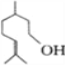 )是两种常见的萜类化合物,有关这两种化合物的说法中正确的是
)是两种常见的萜类化合物,有关这两种化合物的说法中正确的是


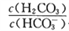 ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。



 ;
; 。
。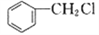 和丙醛合成
和丙醛合成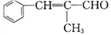 的流程图:_______________________ (其他试剂任选)。
的流程图:_______________________ (其他试剂任选)。