-
下列变化属于放热反应的是( )
① 木炭燃烧 ② 将胆矾加热变为白色粉末 ③ 浓硫酸稀释
④ 氯酸钾分解制氧气 ⑤ 生石灰与水反应生成熟石灰
A. ①②④ B. ①③⑤ C. ①⑤ D. ②④
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.需要加热才能发生的反应一定是吸热反应
B.化学变化过程是原子的重新组合过程
C.生成物总能量高于反应物总能量的反应是吸热反应
D.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
难度: 中等查看答案及解析
-
未来新能源的特点是资源丰富,在使用时对环境无污染或者污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②生物质能 ③潮汐能 ④石油 ⑤太阳能 ⑥煤 ⑦风能 ⑧氢能
A. ①②③④ B. ②③⑤⑦⑧ C. ⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
难度: 简单查看答案及解析
-
热化学方程式C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.3 kJ/mol表示( )
A. 碳和水反应吸收131.3 kJ能量
B. 1 mol碳和1 mol水反应生成一氧化碳和氢气并吸收131.3 kJ热量
C. 1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ
D. 1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
难度: 中等查看答案及解析
-
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的速率v可表示为( )
A. v(NH3)=0.01 mol/(L•s) B. v(O2)=0.00l0 mol/(L•s)
C. v(NO)=0.00l0 mol/(L•s) D. v(H2O)=0.045 mol/(L•s)
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是( )
A. ⊿H1>⊿H2>⊿H3 B. ⊿H1<⊿H3<⊿H2 C. ⊿H1<⊿H2<⊿H3 D. ⊿H1>⊿H3>⊿H2
难度: 简单查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是
A. CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
B. C(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol
C. H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
D. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol
难度: 中等查看答案及解析
-
对于可逆反应A(g)+ 2B(g)
2C(g)(正反应吸热),下列图象中正确的是( )
A.
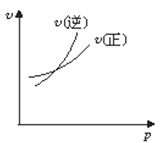 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
对 A + 2B
2C + 3D来说,下列四种不同情况下的反应速率最快的是( )
A. v(A)=0.25 mol/(L•min) B. v(B)=0.6 mol/(L•min)
C. v(C)=0.5 mol/(L•min) D. v(D)=0.6 mol/(L•min)
难度: 简单查看答案及解析
-
一定温度下,在容积一定的容器中,可逆反应A(s)+3B(g)
3C(g)达到平衡的标志是( )
A. 容器内每减少1mol A,同时生成3mol C
B. 容器内的气体密度不再改变
C. 混合气体总的物质的量不变
D. 容器内每减少1mol A,同时消耗3mol B
难度: 简单查看答案及解析
-
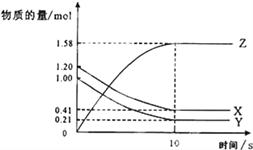
对已达化学平衡的下列反应:2X(g)+Y(g)
2Z(g)减小压强时,对反应产生的影响是( )
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都增大,平衡向正反应方向移动
难度: 中等查看答案及解析
-
电镀废液中Cr2O7可通过下列反应转化成铬黄(PbCrO4):
Cr2O
(aq)+2Pb2+(aq)+H2O(l)
2PbCrO4(s)+2H+(aq) ΔH<0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是 ( )。
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析
-
在密闭容器中,合成氨的反应N2+3H2
2NH3,现将2mol N2和2mol H2通入该容器中反应,20s后生成0.8 mol的NH3,则H2的转换率是多少( )
A. 70% B. 60% C. 50% D. 40%
难度: 简单查看答案及解析
-
右图是373K时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是 ( )

A. 该反应的热化学方程式为:N2+3H2
2NH3 △H=-92kJ·mol-1
B. 加入催化剂,该化学反应的反应热不变
C. a曲线是加入催化剂时的能量变化曲线
D. 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,则Q1=92
难度: 中等查看答案及解析
-
在体积可变的容器中发生反应N2+3H2
2NH3,当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是( )
A. 分子运动速率加快,使反应物分子间的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C. 活化分子百分数未变,但单位体积内活化分子数增加,有效碰撞次数增多
D. 分子间距离减小,使所有的活化分子间的碰撞都成为有效碰撞
难度: 中等查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表

上述四种情况达到平衡后,n(CO)的大小顺序是( )
A. 乙=丁>丙=甲 B. 乙>丁>甲>丙
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
难度: 困难查看答案及解析