-
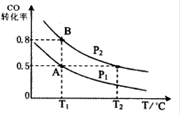
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是( )
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C. Y、Z形成的分子空间构型可能是正四面体
D. WY2分子中δ键与π键的数目之比是2:1
难度: 中等查看答案及解析
-
下列几种氢键:①O—H…O,②N—H…N,③F—H…F,④O—H…N,其强度由强到弱的排列顺序是( )
A.③①④② B.①②③④ C.③②①④ D.①④③②
难度: 简单查看答案及解析
-
只有在化合物中才能存在的化学键是( )
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键
A.①④ B.①②④ C.③⑤ D.①③⑤
难度: 中等查看答案及解析
-
按照混合物、纯净物、强电解质、弱电解质、非电解质的顺序排列正确的一组是( )
A.盐酸、氯气、BaSO4、CO2、SO2
B.硫酸、氨水、醋酸、乙醇、NO2
C.漂白粉、胆矾、NH4Cl、CH3COOH、CO2
D.干冰、氯水、HCl、HClO、CO
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.CHCl3是三角锥形
B.AB2是V形,其A可能为sp2杂化
C.二氧化硅中硅为sp杂化,是非极性分子
D.NH4+是平面四边形结构
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 第三周期所包含的元素中钠的原子半径最小
B. 钠的第一电离能比镁的第一电离能大
C. 在所有元素中,氟的电负性最大
D. 电子云示意图中的每个小黑点都表示一个电子
难度: 中等查看答案及解析
-
下列各项比较中前者高于(或大于或强于)后者的是( )
A.CCl4和SiCl4的熔点
B.邻羟基苯甲醛(
)和对羟基苯甲醛(
)的沸点
C.HF和HCl在水中的溶解度
D.H2SO3和H2SO4的酸性
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.Be(OH)2是两性氢氧化物
B.硫粉不溶于水,易溶于CS2中
C. O3与SO2的结构不相似
D.由下图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
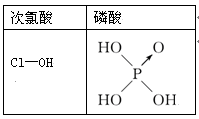
难度: 中等查看答案及解析
-
下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为

C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
难度: 简单查看答案及解析
-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:( )
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知的碳燃烧热ΔH1= a kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH2= c kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH3= b kJ·mol-1 则x为( )
A.3a+b-c B. 3a- c+b C.a+b-c D.c-a-b
难度: 简单查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 简单查看答案及解析
-
具有下列电子层结构的原子,其对应元素一定属于同一周期的是( )
A. 两种原子的电子层上全部都是s电子
B. 3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C. 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
D. 原子核外M层上的s能级和p能级都填满了电子,而d轨道上尚未有电子的两种原子
难度: 简单查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如下图所示.已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是( )
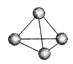
A.N4属于一种新型的化合物
B.N4分子中N—N键角为109°28′
C.N4分子中存在非极性键
D.1 mol N4转变成N2将吸收882 kJ热量
难度: 中等查看答案及解析
-
我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2
CO2+H2O。下列有关说法正确的是( )
A.该反应为吸热反应
B.CO2的分子模型示意图:

C.HCHO分子中既含σ键又含π键
D.每生成1.8 g H2O消耗2.24 L O2
难度: 中等查看答案及解析
-
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是

难度: 困难查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )

①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
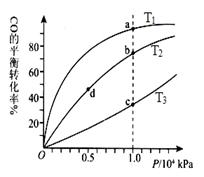
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g)
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
难度: 困难查看答案及解析
-
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是( )
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等
D.六氟化硫分子是极性分子
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. HF、HCl、H2S、PH3的稳定性依次增强
B. 按Mg、Si、N、F的顺序,原子半径由小变大
C. 某主族元素的电离能I1~I7数据如下表所示(单位:kJ/mol),可推测该元素位于元素周期表第ⅤA族

D. 在①P、S,②Mg、Ca,③Al、Si三组元素中,每组中第一电离能较大的元素的原子序数之和为41
难度: 简单查看答案及解析
-
科学家们在研制一种吸气式的锂-空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2
Li2O2下列有关说法正确的是( )
A.充电时,多孔金制成的电极外接电源负极
B.放电时,Li+从负极向正极移动
C.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
D.该电池可使用含Li+的水溶液作电解质溶液
难度: 简单查看答案及解析