-
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是
A.向水中通入SO2 B.将水加热煮沸
C.向纯水中投入一小块金属钠 D.向水中加入NaCl
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.向Na2CO3溶液中滴加酚酞试液变红色 B.实验室保存硫酸亚铁溶液时加入少量铁粉
C.加热FeCl3溶液颜色会变深 D.KAl(SO4)2·12 H2O可用于净水
难度: 中等查看答案及解析
-
升高温度,下列数据不一定增大的是
A.化学反应速率
B.KNO3的溶解度S
C.化学平衡常数K D.水的离子积常数Kw
难度: 中等查看答案及解析
-
下列有关实验原理或实验操作正确的是
A.用蒸馏水湿润的pH试纸测量某溶液的pH=10
B.用10 mL量筒量取0.50 mol·L-1H2SO4溶液5.50 mL
C.向铁钉上镀铜时,铁钉连接直流电源的正极
D.盛装Na2CO3溶液的试剂瓶要使用胶塞
难度: 中等查看答案及解析
-
水的电离过程为:H2O
H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是
A.c(H+)随着温度升高而降低 B.在35℃时,c(H+)>c(OH-)
C.蒸馏水中通HCl, Kw增大 D.水的电离为吸热过程
难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银沉淀溶解平衡体系中,加入碘化钠固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
难度: 中等查看答案及解析
-
下列反应达到化学平衡后,加压或升温都能使化学平衡向逆反应方向移动的是
A.SO2(g)+NO2(g)
SO3(g)+NO(g) ΔH<0
B.C(s)+CO2(g)
2CO(g) ΔH>0
C.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
D.H2S(g)
H2(g)+S(s) ΔH>0
难度: 中等查看答案及解析
-
根据碘与氢气反应的热化学方程式
(1)I2(g)+ H2(g)
2HI(g) ΔH=-9.48 kJ/mol
(2)I2(s)+ H2(g)
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254 g I2(g)中通入2 gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(2)的反应物总能量比反应(1)的反应物总能量低
D.反应(1)的产物比反应(2)的产物稳定
难度: 中等查看答案及解析
-
对下列物质:①H2SO4、②CO2、 ③NaOH、④BaSO4、 ⑤NH3 、⑥SO2、 ⑦NH3·H2O
⑧C2H5OH、⑨Cu、⑩氯化钠溶液,按要求分类不正确的是
A.弱电解质:④、⑦ B.电解质:①、③、④、⑦
C.非电解质:②、⑤、⑥、⑧ D.强电解质:①、③、④
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,符合按pH由小到大的顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S D.NH4Cl (NH4)2SO4 Na2S NaNO3
难度: 中等查看答案及解析
-
在指定的条件下,下列各组离子一定能大量共存的是
A.无色的溶液中:Fe3+、K+、NO3-、Cl-
B.pH=13的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、H+
D.c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO3-
难度: 中等查看答案及解析
-
用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A.CuSO4 B.Na2SO4 C.CuCl2 D.NaCl
难度: 中等查看答案及解析
-
反应CO(g)+NO2(g)
CO2(g)+NO(g) ΔH<0,在温度t1时达到平衡,c1(CO)=c1(NO2)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(NO2),平衡常数为K2,则
A.若增大CO浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(NO2) D.c1(CO)>c2(CO)
难度: 中等查看答案及解析
-
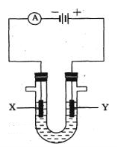
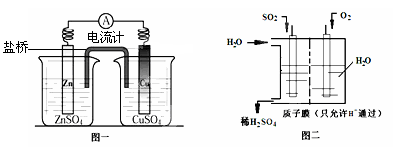
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是
A.a为负极,b为正极 B.a为阳极,b为阴极
C.电解过程中,氯离子浓度不变 D.电解过程中,d电极质量增加
难度: 中等查看答案及解析
-
四个体积相同的密闭容器中在一定的条件下发生反应: 2SO2+O2
2SO3,反应开始时,反应速率由大到小排列顺序正确的是
容器
温度
SO2(mol)
O2(mol)
催化剂
甲
500℃
10
5
-
乙
500℃
10
5
V2O5
丙
450℃
8
5
-
丁
500℃
8
5
-
A.乙>甲>丁>丙 B.乙>甲>丙>丁 C.甲>乙=丁>丙 D.乙>甲>丙=丁
难度: 中等查看答案及解析
-
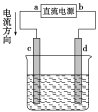
由化学能转化的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e- = 2H2O
D.该装置中a极为正极,发生氧化反应
难度: 中等查看答案及解析
-
物质的量浓度都为0.1 mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.c(OH-)=c(H+)+ c(CH3COOH)
D.c(CH3COOH)+ c(CH3COO-)= c(Na+)
难度: 中等查看答案及解析
-
下列叙述不正确的是:
A.用反应热数据的大小判断不同反应反应速率的快慢
B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.用平衡常数的大小判断化学反应可能进行的程度
难度: 中等查看答案及解析
-
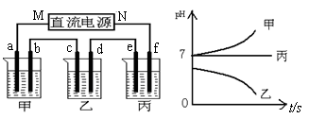
关于下列装置说法正确的是
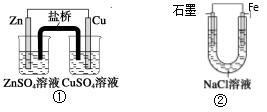
A.装置①中,盐桥中的K+移向CuSO4溶液
B.装置①中,Zn为负极,发生还原反应
C.装置②中的Fe发生析氢腐蚀
D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe
难度: 中等查看答案及解析
-
下列溶液中有关物质的量浓度关系正确的是
A.25 ℃时pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(OH-) = c(H+) + c(CH3COOH)
D.0.1 mol·L-1 的NaHA溶液,其pH=4: c(HA-) > c(H+) > c(H2A) > c(A2-)
难度: 困难查看答案及解析
-
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________________。
(2)上述B步骤操作的目的是__________________________________________。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果________(填“偏
高“、“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是________________________________________。
难度: 中等查看答案及解析