-
根据元素周期表,下列叙述中不正确的是
A. 在地球上,元素的分布和它们在元素周期表中的位置有密切关系
B. 在金属元素区域可以寻找制备新型农药材料的元素
C. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
D. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
难度: 简单查看答案及解析
-
下列化学用语表述正确的是
A. 次氯酸的电子式:
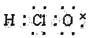 B. 中子数为79、质子数为55 的铯原子:
B. 中子数为79、质子数为55 的铯原子: C. CC14分子的比例模型:
 D. 氯化铵的电子式为:
D. 氯化铵的电子式为:
难度: 简单查看答案及解析
-
同温同压下,有质量相等的H2、D2、T2三种气体,下列叙述中正确的是(用质量数代替相对原子质量)
①密度之比是1:2:3 ②质子数之比是6: 3: 2
③中子数之比是0: 3: 4 ④体积之比是6: 3: 2
A. ①②③④ B. ①② C. ③④ D. ②④
难度: 简单查看答案及解析
-
下列说法正确的是
①核素是指具有一定数目质子和一定数目中子的原子
②分子组成相差一个或若干个CH2原子团的有机物互称为同系物
③某原子的质子数为Z,中子数为N,则该元素的相对原子质量为Z+N
④水的沸点比硫化氢高是因为H-O键强于H-S 键
⑤Fe 位于元素周期表中第四周期、VIIIB族
⑥放电时,原电池的负极质量不一定减少
⑦放电时,电子总是从原电池的负极流向正极,再经电解质流回负极
⑧一个大气压下,1molC完全燃烧生成CO2所放出的热量叫C的燃烧热
⑨因为氯的非金属性强于硫,所以盐酸强于氢硫酸
A. ①③⑥ B. ①⑦⑧ C. ①⑥ D. ⑥⑧
难度: 中等查看答案及解析
-
下列说法正确的是(NA表示阿伏伽德罗常数的值)
A. 一个
原子的质量约为
g
B. 1mol甲基含有7NA个电子
C. 沸点:正戊烧>异丁烷>正丁烷
D. 结构和组成相似的物质,沸点随相对分子质量增大而升高,所以NH3沸点低于PH3
难度: 简单查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生反应:2HI(g)
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
难度: 中等查看答案及解析
-
某元素的单质为双原子分子,其相对分子质量为2n-2,2n,2n+2三种,当n为整数时,以下各值中肯定不是该元素某同位素的质量数的是(用质量数代替相对原子质量)
①n-2 ②n-1 ③n ④n+1
A. ① B. ③ C. ①③ D. ①③④
难度: 简单查看答案及解析
-
下列有关碱金属、卤素结构和性质描述正确的有几句
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高; 密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O
④根据同族元素性质的递变规律推测At2与H2化合较难,砹化银也难溶于水。
⑤根据Cl、Br、I的非金属性递减,可推出HC1、HBr、HI 的还原性依次增强而热稳定性和含氧酸酸性依次减弱。
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
有两种短周期元素X 和Y,可组成化合物XY3,Y的原子序数为m时,X的原子序数为: ①m-4; ②m+4;③m+8;④m-2;⑤m+6。其中正确的组合是
A. ①②④ B. ①②③⑤ C. ①②⑤ D. ①②③④⑤
难度: 中等查看答案及解析
-
C5H12有3种不同结构:甲[CH3(CH2)3CH3]、乙[CH3CH(CH3)CH2CH3]和丙[C(CH3)4],下列相关叙述正确的是
A. 甲、乙、丙属于同系物,均可与氯气、溴蒸气发生取代反应
B. 甲、乙、内都属于烷烃
C. C6H12表示一种纯净物
D. 乙有3种不同沸点的一氯代物
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法中,正确的是
①用铁片和稀硫酸反应制取氡气时,改用98%的浓硫酸可以加快产生氢气的速率
②增加反应物的用量,一定会增大化学反应速率
③决定化学反应速率的主要因素是反应物的浓度
④汽车尾气中的NO和CO反应转化为无害的N2和CO2,增大体积使减小压强时,反应速率减慢,但单位体积内活化分子百分数不变
⑤对于有气态物质参加的反应,增大压强,一定能加快化学反应速率
⑥用锌与稀硫酸反应制H2时,滴加几滴硫酸铜溶液能加快反应速率
⑦使用催化剂,使反应的活化能降低,单位体积内活化分子百分数增大,反应速率加快
⑧光是影响某些化学反应速率的外界条件之一
A. ①⑤⑥⑧ B. ④⑥⑦⑧ C. ②④⑥⑧ D. ③⑥⑧
难度: 中等查看答案及解析
-
如图是部分短周期元素原子半径与原子序数的关系图。字母代表元素,分析正确的是
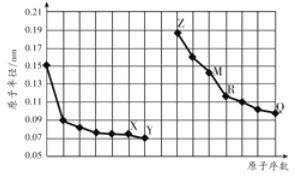
A. R在周期表的第15列
B. Y、Q两种元素的气态氢化物及其最高价氧化物的水化物均为强酸
C. 简单离子的半径:X>Z>M
D. Z的单质能从M与Q元素构成的盐溶液中置换出单质M
难度: 中等查看答案及解析
-
利用反应 6NO2 + 8NH3===7N2 + 12H2O 构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示,下列说法不正确的是 ( )
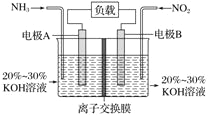
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极 A 极反应式为 2NH3 - 6e- ===N2 + 6H+
D. 当有 4.48 L NO2( 标准状况 ) 被处理时,转移电子为 0.8 mol
难度: 困难查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol
Na2O2(s)+ CO2(g)==Na2CO3(s)+1/202(g) △H=-226kJ/mol
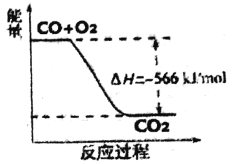
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283kJ
B. 上图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(g)==2Na2CO3(s)+ 02(g) △H<-452kJ/mol
D. CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数约为2×6.02×1023
难度: 中等查看答案及解析
-
某烃的相对分子质量为86,分子中含有1个-CH2-、1个
和若干个一CH3,该烃的一氯代物有
A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
下列说法正确的有几句
①离子键与共价键的本质都是静电作用
②任何物质中都存在化学键
③氢键是极弱的化学键
④离子键就是阴、阳离子之间的静电吸引力
⑤活泼金属与活泼非金属化合时能形成离子键
⑥任何共价键中,成键原子键后均满足稳定结构
⑦验证化合物是否为离子化合物的实验方法是可以看其熔化状态下能否导电
⑧两种非金属元素形成的化合物不可能含有离子键
⑨化学键断裂,一定发生化学变化
A. 1 B. 2 C. 3 D. 4
难度: 中等查看答案及解析
-
实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学设计了实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
实验试剂
甲
乙
丙
丁
4 mol·L-1 H2SO4/mL
20
V1
V2
V3
饱和CuSO4溶液/mL
0
2.5
V4
10
H2O/mL
V5
V6
8
0
收集气体所需时间/s
t1
t2
t3
t4
下列说法正确的是( )
A. t1<t2<t3<t4 B. V4=V5=10
C. V6=7.5 D. V1<V2<V3<20
难度: 中等查看答案及解析
-
将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g)。能判断该分解反应已经达到化学平衡的是
A. v(NH3)=2v(CO2)
B. 密闭容器中NH3体积分数不变
C. 密闭容器中混合气体的平均相对分子质量不变
D. 密闭容器中混合气体的密度不变
难度: 中等查看答案及解析
-
密闭容器中进行如下反应: X(g) +3Y(g)
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X 为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
难度: 中等查看答案及解析
-
NH3和纯净的O2在一定条件下发生反应; 4NH3(g) +3O2(g)
2N2(g)+6H2O(g),现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O 占混合气体体积的40%,则下列表示此段时间内该反应的平均速率不正确的是
A. v(O2)=0.225 mol/(L·min) B. v(H2O)=0.375 mol/(L·min)
C. v(N2) =0.125 mol/(L·min) D. v(NH3)=0.250 mol/(L·min)
难度: 中等查看答案及解析
-
LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池,图乙是LED发光二极管的装置示意图。下列叙述错误的是

A.电池A极区的电极反应式为:H2O2+2e-=2OH-
B.电池放电过程中,Na+从负极区向正极区移动
C.每有1mol NaBH4参加反应转移电子数为4NA
D.要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连
难度: 困难查看答案及解析
-
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A. 若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B. 若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C. 若丙中含有第2 周期IVA 族的元素,则丙可能是甲烷的同系物
D. 若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有-1价的元素
难度: 简单查看答案及解析