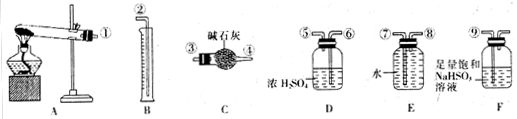
-
化学与材料、生活和环境密切相关。下列有关说法中错误的是
A.绚丽缤纷的烟花中添加了含钾、钙、钠、铜等金属化合物
B.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
C.光导纤维具有很强的导电能力,故大量用于制造通讯光缆
D.将海水提盐后的苦卤浓缩、氧化,再鼓入热空气可提取中的溴
难度: 简单查看答案及解析
-
下列表中对于相关物质的分类全部正确的一组是
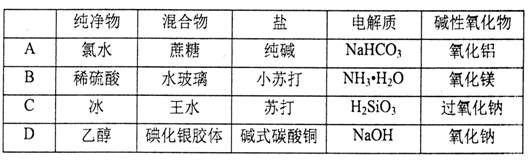
难度: 中等查看答案及解析
-
重水(D2O)主要用于核反应堆中中子的减速剂和冷却剂,在化学和生物学中,重水常用作示踪物质来研究反应机理等。下列说法正确的是
A.D是氢的一种核素,原子核内有2个中子
B.1H218O与D216O的相对分子质量相同
C.3H2O与D2O互称同位素
D.通过化学变化可以直接实现普通水向重水转化
难度: 中等查看答案及解析
-
下列反应中,反应后固体物质增重的是
A.二氧化碳通过Na2O2粉末
B.铝与Fe2O3发生铝热反应
C.碳与SiO2电炉中抽取粗硅
D.将锌片投入CuSO4溶液中
难度: 中等查看答案及解析
-
下列叙述正确的是
A.SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.少量金属钠通常保存在煤油中,着火时可用细沙覆盖灭火
D.实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液
难度: 中等查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A.
半径逐渐减小
B.还原性强弱:
C.核外电子排布相同的微粒化学性质一定相同
D.同主族元素含氧酸的酸性随核电荷数的增加而减弱
难度: 中等查看答案及解析
-
“玉兔号”巡月器的发动机套有一件“土豪金”外衣——耐高温、抗震复合材料,该复合材料以硅酸铝纤维(Al2O3—SiO2)为基体,六钛酸钾晶须(K2O·6TiO2)为增强剂。下列说法中正确的是
A.该复合材料属于新型有机非金属材料
B.Al、K、Ti都属于主族元素
C.原子半径:K>Si>O
D.该复合材料能耐强酸和强碱腐蚀
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列叙述错误的是
A.在1.8g18O2中含有NA个质子
B.28gC2H4中含有4NA个C—H键
C.常温下,2.7g铝片投入足量的稀硫酸中,铝失去的电子数为0.3NA
D.4.6gNa完全转化成Na2O和Na2O2的混合物,生成物中阴离子总数为0.1NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是
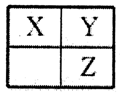
A.若Z的核电荷数是Y的两倍,则X为碳元素
B.若X、Y、Z的单质常温下都是气体,则Y为氧元素
C.若X、Y、Z都是非金属元素,则它们气态氢化物的水溶液都显酸性
D.若X、Y、Z的原子序数之和等于25,则它们都是非金属元素
难度: 简单查看答案及解析
-
进行下列实验,由实验现象得出的结论正确的是
A.某气体能使湿润的淀粉KI试纸变蓝,该气体一定是Cl2
B.向某溶液中滴加KSCN溶液,溶液显红色,该溶液中含有Fe3+
C.向某溶液中逐滴滴加稀氨水至过量,先产生白色沉淀然后沉淀溶解,该溶液中含有Al3+
D.向某溶液中通入CO2溶液变浑浊,继续通CO2浑浊消失,该溶液可能是Na2SiO3溶液
难度: 中等查看答案及解析
-
下列实验现象所对应的离子方程式正确的是
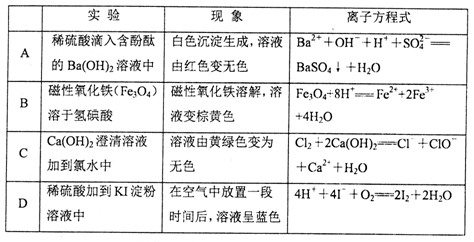
难度: 困难查看答案及解析
-
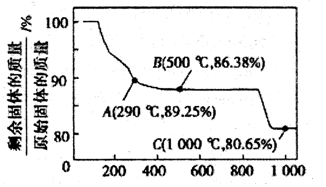
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
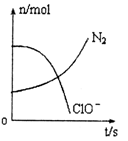
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.氧化剂与还原剂的化学计量数之比为5:2
D.若生成2.24LN2,则转移电子必定为1mol
难度: 中等查看答案及解析
-
下列画有横线的反应物在反应中不能完全消耗的是
A.将含有少量CO2的CO通入足量Na2O2的试管中并不断用电火花引燃
B.向等物质的量的干冰和CaO的混合物中加几滴水
C.将1molCu置于含2molH2SO4的浓溶液中加热
D.在强光持续照射下,向过量的Ca(ClO)2浊液中通入少量的CO2
难度: 中等查看答案及解析
-
下列现象或事实能用同一原理解释的是
A.氯化铵晶体和碘晶体加热都产生气体
B.KMnO4、二氧化锰分别与浓盐酸混合(可加热),都产生黄绿色气体
C.常温下铁和铂都不溶于浓硝酸
D.SO2通入BaCl2溶液至饱和,再加入硝酸或苛性钠溶液,都能产生白色沉淀
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
,下列有关物质的推断正确的是
A.若甲为Al,则丁可能是NaOH溶液
B.若甲为氮气,则丁可能是O2
C.若甲为Fe,则丁可能是盐酸
D.若甲为Ca(OH)2溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
向体积均为10mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是
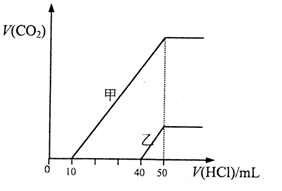
A.当0<V(HCl)<10mL时,甲溶液中发生反应的离子方程式为:
B.乙溶液中含有的溶质是NaOH、NaHCO3
C.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
D.原NaOH溶液的物质的量浓度为0.5mol·L-1
难度: 困难查看答案及解析