-
以下是利用主要成分为Cu2S和Fe2O3的工业废弃固体(其他成分不参与反应)制备有关物质,实验流程如图所示:
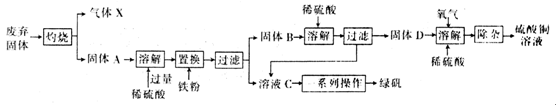
回答下列问题:
(1)气体X的化学式为 。
(2)加入铁粉时发生反应的离子方程式为:2H++Fe Fe2++H2↑、 。
Fe2++H2↑、 。
(3)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量绿矾后随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O、 。
(4)除杂时需先加合适的氧化剂将Fe2+氧化为Fe3+,再加试剂Y调节溶液pH以除去Fe3+,则氧化剂及试剂Y可以是 (填编号)。
a.H2O2、CuO b.HNO3、Cu(OH)2
c.KMnO4、CuCl2 d.漂白粉、CuCO3
(5)无水硫酸铜受热分解生成氧化铜和气体,受热温度不同气体可能为SO3、SO2和O2中的一种、两种或三种。现设计如下实验测定产生的SO2、SO3和O2的物质的量,并计算各物质的化学计量数,从而确定CuSO4分解的化学方程式(已知实验结束时,硫酸铜完全分解)。
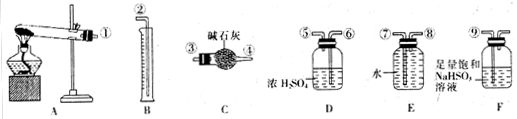
①仪器C的名称是 。
②组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为:
①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。仪器F的作用是 。
③若某小组称取6.4g无水CuSO4,实验过程中装置C增加的质量为3.84g,量筒中水的体积折算成标准状况下气体体积224mL,请通过计算确定实验条件下CuSO4分解的化学方程式: 。
-
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答:

(1)气体a的化学式为________。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式________。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为________。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意________。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
-
某实验小组用工业上废弃固体(主要成分为Cu2S和Fe2O3混合物)制取铜和FeCl3固体,设计的操作流程如下:
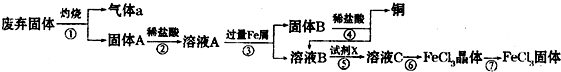
(1)除酒精灯和铁架台或三角架外,①中所需的容器为______,①和⑥中都用到的仪器为______.
(2)固体B加入稀盐酸后,④的操作是______.
(3)试剂x的化学式为______,X与溶液B反应的离子方程式为______.
(4)在实验室中,用36.5%的盐酸,配制1L 3mol•L-1的盐酸,则需量取36.5%的盐酸______mL.
(5)简述溶液C中所含金属阳离子的检验方法______.
(6)第⑦步操作中,所需装置如图所示:
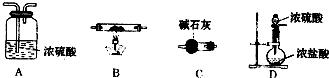
①按气流方向从左到右的顺序,各装置的连接顺序为______.
②C的作用是______.
-
(10分)某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
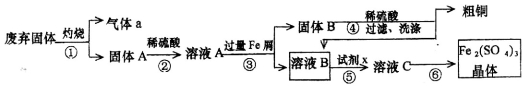
(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为_____;①和⑥中都用到的玻璃仪器为_______;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式____________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象_______。
-
(14分)
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
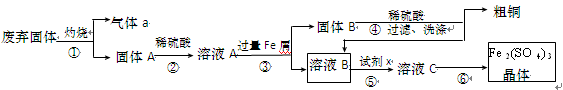
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为________、
________,①和⑥中都用到的仪器为________;
(2)试剂x的化学式为________;x与溶液B反应的离子方程式为________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1 硫酸、1.0 mol·L-1 NaOH溶液、0.1 mol·L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证乙同学的猜测是否合理。简要说明实验步骤和现象;
(4)某同学用实验制得的Fe2(SO4)3 晶体配制0.1 mol·L-1 的Fe2(SO4)3 溶液,在称量出Fe2(SO4)3 晶体后,溶解该晶体的具体操作为________。
-
(10分)某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
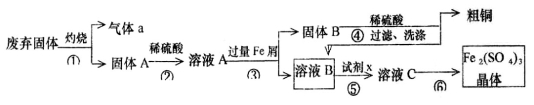
(1)除酒精灯和铁架台或三脚架外,①中所需的容器为_____;①和⑥中都用到的玻璃仪器为_______;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式为________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN—被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol/L硫酸、1.0 mol/LNaOH溶液、0.1 mol/LFe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合趣实验验证乙同学的猜测是否合理。简要说明实验步骤和现象______________。
-
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:

(1)除酒精灯和铁架台(或三脚架)外,①中所需的容器为__________;①和⑥中都用到的玻璃仪器为________________;
(2)已知试剂x为过氧化氢,写出H2O2与溶液B反应的离子方程式_______________________;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1硫酸、1.0 mol·L-1NaOH溶液、0.1 mol·L-1Fe2(SO4)3;溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证该同学的猜测是否合理。简要说明实验步骤和现象________________。
-
过二硫酸铵[(NH4)2S2O8]是一种常用的氧化剂和漂白剂。一种以辉铜矿(主要成分为Cu2S,且杂质不参与下列流程中的反应)为原料制备过二硫酸铵的流程如图所示:
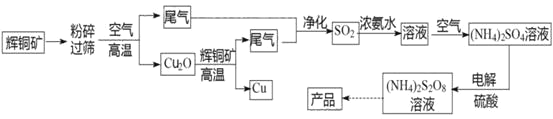
请回答下列问题:
(1)矿石“粉碎”的目的是________
(2)Cu2O和辉铜矿在高温下反应的化学方程式为________。在该反应中,n(氧化剂):n(还原剂)=________。
(3)工业上,常采用电解法制取(NH4)2S2O8,其装置如下图所示。则电解时,阳极的电极反应式为:________。当电路中转移2.5mol电子时,阴极产生________(填数值)mol________(填物质)。

(4)从过二硫酸铵溶液中获得过二硫酸铵晶体,需采用蒸发浓缩、降温结晶、________、________、干燥等操作。
(5)过二硫酸铵常用于检验废水中的Cr3+是否超标,如果超标,溶液会变成橙色(还原产物为SO42-),写出该反应的离子方程式________。
-
某化学兴趣小组利用工业废弃固体(主要成分为Cu2S和FeS2)制备硫酸铜溶液和硫酸亚铁晶体,设计方案如图所示:
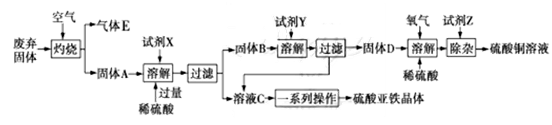
已知:T℃时,Ksp[Cu(OH)2]=2.0×10−20,Ksp[Fe(OH)2]=6.0×10−16,
Ksp[Fe(OH)3]=1.0×10−38。
(1)为了提高废弃固体的灼烧速率,可以采取的措施有____________、___________(写出两条)。
(2)FeS2在空气中灼烧时氧化剂与还原剂的物质的量之比为________。
(3)溶液C在氮气的环境下,通过____________、____________、过滤、洗涤、干燥制取硫酸亚铁晶体。
(4)常温下,固体D、O2和稀硫酸混合后几乎不反应,但加入少量溶液C立即发生反应,则溶液C对该反应起________作用,其中发生反应的离子方程式为_______________________________、__________________________________。
(5)除杂时先加入双氧水,然后加入试剂Z调节溶液的pH值使铁离子完全沉淀:
①加入的试剂Z可以是________。
A. NaOH B.CuO C.Cu(OH)2 D.NH3·H2O
②若除杂时溶液中Cu2+浓度为2.0mol·L−1,则加入试剂Z调节溶液的pH至_______________________。
-
某化学学习小组利用某工业废弃固体(主要成分为Cu2S和FeS2)制备硫酸铜溶液和硫酸亚铁晶体,设计方案如图所示:

已知:Ksp[Cu(OH)2]=6.0×10-20,Ksp[Fe(OH)2]=1.6×10-14,Ksp[Fe(OH)3]=1.0×10-38.
(1)写出FeS2在空气中灼烧的化学方程式:______________________。
(2)试剂X为________,试剂Y为_____________。
(3)溶液C通过__________、__________、过滤等操作得到硫酸亚铁晶体。
(4)常温下,固体D、O2和稀硫酸混合后几乎不反应,而加少量溶液C随即发生反应。已知FeSO4对此反应起催化作用,则催化过程中反应的离子方程式为_____________________、Cu+2Fe3+=2Fe2++Cu2+。
(5)除杂时需加入双氧水,然后加入试剂Z以调节pH使得铁元素全部沉淀(含铁元素的离子浓度小于10-5mol/L)。试剂Z可以是________,溶液的pH应≥____________。

Fe2++H2↑、 。











