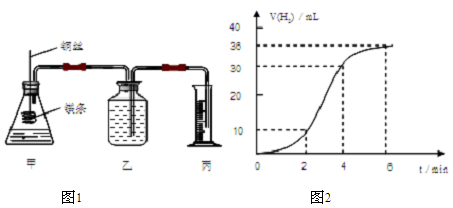
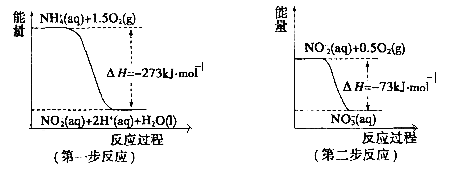
-
下列有关能量变化和原因的相关叙述正确的是
A.反应是放热还是吸热,必须看反应物和生成物所具有的总能量的相对大小
B.铝热剂焊接钢轨主要利用的是光能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.Ba(OH)2·8H2O晶体与NH4Cl晶体的反应是放热反应
难度: 简单查看答案及解析
-
下列热化学方程式的书写,正确的是
A.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2 +3H2
2NH3 ΔH=-38.6 kJ·mol-1
B.已知在105Pa, 298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g) + 1/2O2(g) == H2O(g) ΔH=-242 kJ·mol-1
C.甲烷的标准燃烧热数值为890.3 kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g) + 2O2(g)= CO2(g) + 2H2O(g) ΔH= -890.3 kJ/mol
D.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,则浓硫酸与稀NaOH溶液反应生成1 mol水时放出的热量为57.3 kJ。
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.2.4 g镁变为镁离子失去的电子数为0.1NA
B.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
C.标准状况下,2.24L四氯化碳含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,当生成0.2molO2时,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项
表述I
表述II
A
氯气具有强氧化性
氯水能使有色物质褪色
B
SiO2既能与酸,又能与碱反应
SiO2是两性氧化物
C
锌的金属性比铁强
海轮外壳上装锌块可减缓腐蚀
D
Na2S还原性强
用于除去废水中的Cu2+和Hg2+
难度: 中等查看答案及解析
-
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法错误的是
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应式为:CH3OH-6e-+8OH-=CO32—+6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是
A.钢铁在弱碱性条件下发生电化学腐蚀的正极电极反应式:O2+2H2O+4e-===4OH-
B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C.牺牲阳极的阴极保护法,实际上“牺牲”的是原电池的负极
D.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
难度: 中等查看答案及解析
-
其他条件不变时只改变下列条件,一定能使反应速率加快的是
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
难度: 中等查看答案及解析