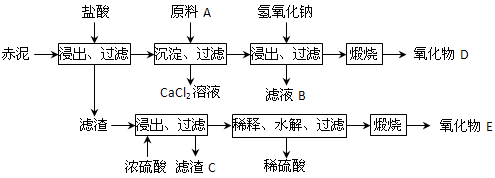
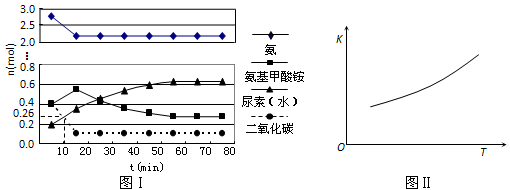
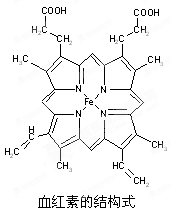
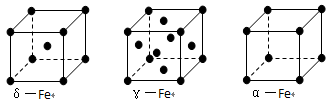
-
在“十二五”期间,江苏省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.加大稀土资源的开采和出口,保证经济快速发展
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
难度: 简单查看答案及解析
-
下列有关化学用语使用正确的是
A.CO2的电子式:
B.核内有8个中子的碳原子:
C.Cl-离子的结构示意图:
D.乙烯的比例模型:

难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA
B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA
D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA
难度: 简单查看答案及解析
-
下列有关实验原理或操作正确的是
A.用洁净无锈的铁丝蘸取待测液,在酒精灯火焰上灼烧,检验钠离子
B.用10mL量筒量取7.80mL浓硫酸
C.在蒸发皿中灼烧氢氧化铁获得铁红
D.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解,是因为铜可直接与1mol/L稀硫酸反应
难度: 简单查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是
A.pH=14的溶液中:Na+、Al3+、Cl-、NO3—
B.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42—4、Cl-
C.c(H+)/c(OH-)=1012的溶液中:NH4+、K+ 、HCO3—4、NO3—4
D.c(I-)=0.1mol/L的溶液,Na+、Fe3+、ClO-、SO42—4
难度: 简单查看答案及解析
-
下列有关物质的性质、应用或制取的说法正确的是
A.氯气通入澄清石灰水中,制取漂白粉
B.除去氯化钙溶液中少量盐酸,加入足量碳酸钙粉末,充分搅拌再过滤
C.自来水厂可用硫酸铁对水进行消毒杀菌
D.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
难度: 简单查看答案及解析
-
下列离子方程式表达不正确的是
A.在硫酸亚铁溶液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O
B.用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:
Mg(OH)2 +2NH4+=Mg2++2NH3·H2O
C.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O
2Cu↓ +O2↑ +4H+
D.酸性高锰酸钾和过氧化氢制取少量氧气:
4MnO4—+4H2O2+12H+=4Mn2++7O2↑+10H2O
难度: 简单查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是
A.原子半径:D>E>B>C>A
B.热稳定性:EA4>A2C
C.B、D可形成化合物D2B3
D.化合物DC与化合物EC2中化学键类型相同
难度: 简单查看答案及解析
-
下列有关物质的性质或应用的说法中正确的是
A.铝合金是一种混合物,它比纯铝的熔点高
B.高炉中的主要反应是高温下焦炭和氧化铁直接作用炼出生铁
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.电解从海水中得到的氯化镁溶液可获得金属镁
难度: 简单查看答案及解析
-
下表所列各组物质中,不能通过一步反应实现如图所示转化的是
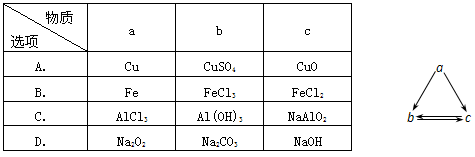
难度: 简单查看答案及解析
-
下列说法正确的是
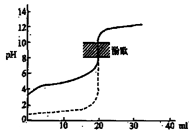
A.△H>0的反应,常温下一定不能自发进行
B.用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D.恒容密闭容器中进行的反应3A(g)
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
难度: 简单查看答案及解析
-
我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:
Pb+PbO2+2H2SO4 = 2PbSO4+2H2O,下列有关说法正确的是
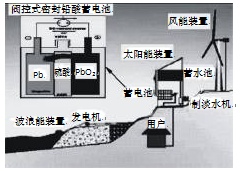
A.图中涉及的能量转化方式只有3种
B.该发电工艺可实现零排放
C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+
D.储能时若充电时间过长,阳极流向阴极的气体可能是H2
难度: 简单查看答案及解析
-
下列有关实验操作或实验原理正确的是
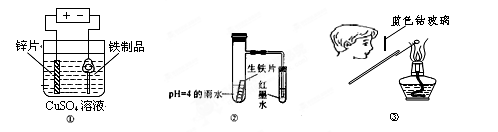
A.用图①装置在铁制品表面镀锌
B.用蒸发溶剂的方法,将10%的氯化铁溶液变为20%的氯化铁溶液
C.用图②装置验证生铁片在pH=4的雨水中发生析氢还是吸氧腐蚀
D.用图③装置检验K2CO3中的K+
难度: 简单查看答案及解析
-
常温下,向0.1 mol·L-1的CH3COONa溶液中逐滴滴加等浓度的HCl溶液,则下列关系正确的是
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.c(Na+)=c(CH3COOH)+c(CH3COO-)
D.c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
难度: 简单查看答案及解析
-
向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A.充入2 mol SO3后,SO2的物质的量增大
B.第一次反应达到平衡时共放出热量176.4 kJ
C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
难度: 简单查看答案及解析