-
2012年,IUPAC正式命名了116号元素,但117号元素尚未被正式认定。下列关于
的说法,错误的是
A.是两种原子 B.互为同位素
C.中子数分别为176和177 D.电子数相差1
难度: 简单查看答案及解析
-
下列有关物质用途的说法,错误的是
A.二氧化硫常用于漂白纸浆 B.漂粉精可用于游泳池水消毒
C.晶体硅常用于制作光导纤维 D.氧化铁常用于红色油漆和涂料
难度: 中等查看答案及解析
-
下列化学用语或模型表示正确的是
A.硝基苯的结构简式:
B.CO2分子比例模型:
C.NH4Cl的电子式:
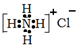 D.NaCl的晶体模型:
D.NaCl的晶体模型:难度: 中等查看答案及解析
-
石头纸是用碳酸钙粉末为主要原料,加少量聚乙烯和胶合剂制成。下列关于“石头纸”的说法中错误的是
A.石头纸不宜在高温条件下生产
B.石头纸能耐酸和碱的腐蚀
C.石头纸不易燃烧
D.使用石头纸,有利于保护森林,且环保
难度: 中等查看答案及解析
-
只含非金属元素的晶体描述正确的是
A.有可能是金属晶体 B.有可能是离子晶体
C.一定是分子晶体 D.一定不是原子晶体
难度: 中等查看答案及解析
-
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2
TiCl4+2CO。下列关于该反应的说法正确的是
A.TiO2是氧化剂
B.氧化剂与还原剂的物质的量之比为1:1
C.Cl2发生氧化反应
D.当2 mol C参加反应时,转移的电子数目为2 mol
难度: 中等查看答案及解析
-
香柠檬酚具有抗氧化功能,它的结构简式如右图,下列说法正确的是

A.它的分子式为C13H9O4
B.它与H2发生加成反应,1mol最多可消耗7mol H2
C.它与Br2发生取代反应,1mol最多消耗3mol Br2
D.它与NaOH溶液反应,1mol最多消耗3molNaOH
难度: 中等查看答案及解析
-
下列各组离子能大量共存于同一溶液中,且加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的是
A.Ba2+、Mg2+、NO3-、CO32- B.Na+、Al3+、Cl-、AlO2-
C.Ba2+、K+、Cl-、HCO3- D.NH4+、Fe3+、Ba2+、Cl-
难度: 中等查看答案及解析
-
已知33As、35Br位于同一周期,下列关系正确的是
A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBr
C.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO4
难度: 中等查看答案及解析
-
已知2H2(g)+O2(g) →2H2O(l)+571.6kJ,2H2(g)+O2(g) →2H2O(g)+483.6kJ。下列说法正确的是
A.2 molH2(g)和1molO2(g)的总能量小于2mol H2O (l)的能量
B.1 mol H2O (g)分解成H2(g)和O2 (g),吸收241.8kJ能量
C.1mol H2O (l)变成1mo1 H2O (g),吸收88 kJ能量
D.等质量的H2O (g)比H2O(l)所含能量低
难度: 中等查看答案及解析
-
对于(NH4)2SO4溶液,下列说法正确的是
A.溶液中存在电离平衡:(NH4)2SO4
2NH4+ + SO42-
B.向溶液中滴加少量浓硫酸,c(NH4+)与c(SO42-)均增大
C.加水稀释,溶液中所有离子的浓度均减小
D.溶液中:c(SO42-)=2c(NH4+) + 2c(NH3·H2O)
难度: 中等查看答案及解析
-
如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)

A.反应前气体反应物的总体积为0.224 L
B.生成物的分子个数为0.005 NA
C.产物中的N-H键个数为0.02NA
D.加水溶解后所得溶液中NH4+数目为0.005 NA
难度: 中等查看答案及解析
-
下列反应产生的气体,通入Na2SO3溶液不反应的是
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸共热
④浓硝酸和铜片 ⑤铜片和浓硫酸共热
A. ② B. ①② C.①②⑤ D. ②④⑤
难度: 中等查看答案及解析
-
下表实验中“操作及现象”与“给定溶液”的性质不对应的是
选项 溶液 操作及现象
A Ca(OH)2溶液 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。
B
溶液 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。
C Ca(ClO)2溶液 通入CO2,溶液没有明显变化。再滴入品红溶液,红色褪去。
D CaCl2溶液 通入CO2,溶液没有明显变化。若同时通入CO2和NH3,则溶液变浑浊。
难度: 中等查看答案及解析
-
对如图所示的实验装置的判断中错误的是

A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e→H2↑
难度: 中等查看答案及解析
-
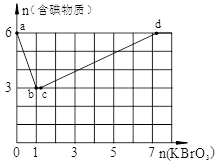
常温下,向物质的量浓度均为0.1mol·L-1的盐酸和氯化钙的混合溶液中逐滴加入0.1mol/L碳酸钠溶液至沉淀刚好完全。下图中关系正确的是

难度: 中等查看答案及解析
-
向三份均为100mL0.5mol·L-1NaHCO3溶液中,分别加入少量冰醋酸、Ca(OH)2固体、NaAlO2固体(忽略溶液体积变化),则三份溶液中c(CO32-)的变化依次为
A.减小、减小、增大 B.减小、增大、增大
C.增大、减小、减小 D.减小、增大、减小
难度: 中等查看答案及解析
-
溴水中存在着如下的平衡:Br2+H2O
HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是
A.加压 B.加入NaF晶体 C.通入SO2气体 D.加入NaI晶体
难度: 中等查看答案及解析
-
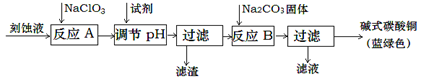
下列实验设计能够成功的是
A.检验亚硫酸钠试样是否变质:

B.检验某卤代烃是否是氯代烃:

C.证明酸性条件H2O2氧化性比I2强:

D.除去氯化钠晶体中少量硝酸钾:
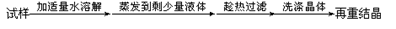
难度: 中等查看答案及解析
-
常温下将一定浓度的一元酸HA和0.1 mol·L-1NaOH溶液等体积混合后,下列说法正确的是
A.若pH=7,HA的浓度一定为0.1 mol·L-1
B.若pH>7,HA的pH不可能等于1
C.若pH<7,溶液中的微粒浓度关系为: c(Na+)=c(HA)+c(A-)
D.若pH=12,且HA为强酸时,HA的浓度应为0.08 mol·L-1
难度: 中等查看答案及解析
-
向10mL 0.1mol·L-1 (NH4)Al(SO4)2溶液中滴加等浓度Ba(OH)2溶液x mL。下列表述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+)
B.x=20时溶液导电能力比x=15时溶液导电能力强
C.x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-)
D.x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O
难度: 中等查看答案及解析
-
两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比为
A.3:2 B.2:1 C.8:1 D.2:9
难度: 中等查看答案及解析
-
黑火药是中国四大发明之一,其爆炸的化学反应方程式是:
2KNO3 + 3C + S→
+ N2↑ + 3CO2↑
(1)方程式中第二周期元素中非金属性由强到弱的顺序依次为________。
(2)上述元素中,元素原子最外层有2个未成对电子的是________。
(3)在生成物中:A物质的晶体类型为________;构成晶体A的微粒半径大小关系为________(用微粒符号表示);含极性共价键的非极性分子为________。
(4)已知CN—与N2结构相似,写出HCN分子的结构式________。
难度: 中等查看答案及解析