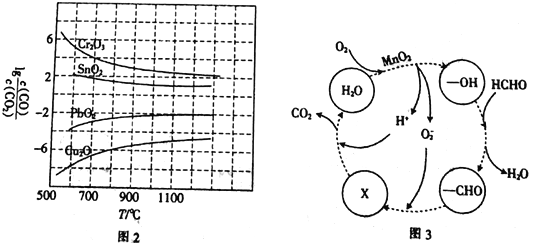
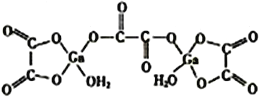
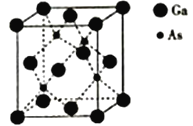
-
下列物品中,没有同时使用金属材料、无机非金属材料和合成高分子材料的是
A.
 智能手机 B.
智能手机 B.  “农家乐”铁锅 C.
“农家乐”铁锅 C.  共享单车 D.
共享单车 D.  儿童智能手表
儿童智能手表难度: 简单查看答案及解析
-
曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列有关叙述不正确的是

A. 脱氧曲酸的分子式为C6H4O3
B. 脱氧曲酸能发生加成反应和酯化反应
C. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
D. 与脱氧曲酸互为同分异构体的芳香族化合物有3种(不考虑—O—O—键)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列有关叙述错误的是
A. 28g 由N2 与CO组成的混合气体中所含的原子数为2NA
B. 78g Na2O2 中所含的阴离子数为NA
C. 0.1molSO2 与0.1molO2充分反应后生成的SO2分子数为0.1 NA
D. 0.1molCu溶于足量稀硝酸中,转移的电子数为0.2 NA
难度: 中等查看答案及解析
-
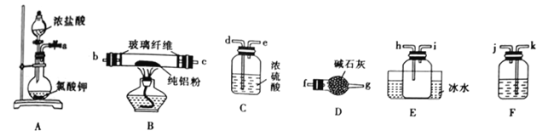
下列实验操作规范且能达到相应实验目的的是
选项
实验目的
实验操作
A
取 20.00 mLKMnO4 溶液
从碱式滴定管初始读数为1.00放液体到最终读数为21.00
B
证明Ksp(BaSO4)<Ksp(BaCO3)
向BaSO4悬浊液中通入足量CO2
C
配制100mL1.8mol·L-1硫酸
量取10mL1.8mol·L-1浓硫酸,倒入100mL容瓶中,然后加水稀释至刻度
D
分离KClO3与MnO2制O2 后的残渣
溶解、过滤、洗涤、干燥滤渣得到MnO2,滤液蒸发结晶并干燥得到KCl
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,四种原子的最外层电子数之和为20。X原子的电子层数与最外层电子数之比为1∶3,Y原子的最外层电子数与其内层电子总数之比为1∶5。下列说法正确的是
A. 最简单气态氢化物的稳定性:W>X B. 简单离子的半径:Y<X
C. W、Z的最高价氧化物对应的水化物均为弱酸 D. 化合物WX、YZ2中化学键类型相同
难度: 中等查看答案及解析
-
下图所示为镍锌可充电电池放电时电极发生物质转化的示意图,电池使用KOH和K2Zn(OH)4为电解质溶液,下列关于该电池说法正确的是
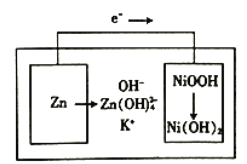
A. 放电时溶液中的K+移向负极 B. 充电时阴极附迁的pH会降低
C. 理论上负极质量每减少6.5g,溶液质量增加6.3g D. 放电时正极反应为H++NiOOH+e-=Ni(OH)2
难度: 中等查看答案及解析
-
常温下,在10 mL 0.1 mol•L-1Na2CO3溶液中逐滴加入0.1 mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2 因逸出未画出,忽略因气体遭出而引起的溶液体积变化),下列说法正确的是
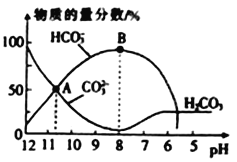
A. A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+ c(OH-)
B. 在B点所示的溶液中,浓度最大的离子是HCO3-
C. 当熔液的pH 为7时,溶液中的阴离子只有两种
D. 已知25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-)
难度: 中等查看答案及解析

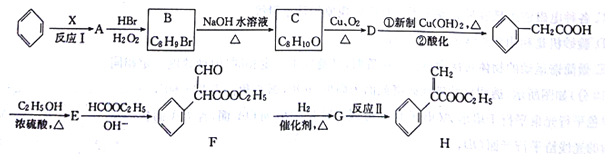
 。利用Claisen反应制备化合物H的一种合成路线如下:
。利用Claisen反应制备化合物H的一种合成路线如下: