-
下列组合中在任何温度下反应均能自发进行的是 ( )
A、△H >0,△S >0 B、△H <0,△S <0
C、△H >0,△S <0 D、△H <0,△S >0
难度: 困难查看答案及解析
-
下列关于电解池中形成的闭合回路的叙述中,正确的是 ( )
A.电解池中的闭合回路仅是由电子的定向运动形成的
B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极
C.在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动
D.相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相同
难度: 中等查看答案及解析
-
下列说法中,不正确的是 ( )
A.电解精炼铜时,粗铜中的金、银、锌等形成阳极泥而与铜分离
B.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.用铝质铆钉焊接铁板,铁不易被腐蚀
D.钢铁设备与外加直流电源的负极相连可以防止钢铁腐蚀
难度: 中等查看答案及解析
-
在理论上不能用于设计原电池的化学反应是 ( )
A.Al(OH)3(s)+NaOH(aq) Na[Al(OH)4](aq) △H<0
B.CH3CH2OH(l)+3O2(g)→2CO2(g)+3H2O(l) △H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3 △H<0
D.H2(g)+Cl2(g) 2HCl(g) △H<0
难度: 中等查看答案及解析
-
250℃和1.01×105Pa时, 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ/mol,自发进行的原因是 ( )
A、是吸热反应 B、是放热反应
C、是熵减少的反应 D、熵增大效应大于焓增大的效应
难度: 简单查看答案及解析
-
某一反应在一定条件下的平衡转化率为25.3%,当有一催化剂存在时,其转化率为( )
A.大于25.3% B.小于25.3% C.等于25.3% D.约等于25.3%
难度: 中等查看答案及解析
-
反应CO+H2O(g)
CO2+H2在1000 K达到平衡时,分别改变下列条件,K值发生变化的是 ( )
A.将压强减小至原来的一半 B.将反应温度升高至1200 K
C.添加催化剂 D.增大水蒸气的浓度
难度: 中等查看答案及解析
-
下列说法中正确的是 ( )
A、平衡常数的大小与起始浓度有关 B、K值越大,反应的转化率越小
C、K值越大,反应的转化率越大 D、温度越高,K值越大
难度: 困难查看答案及解析
-
汽车尾气净化中的一个反应如下: NO(g)+CO(g)
N2(g)+CO2(g)
H =-373.4 kJ·mol-1 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是 ( C )
难度: 中等查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是 ( )
A.CH3OH(g)+O2(g) → H2O(1)+CO2(g)+2H+(aq)+2e-
B.O2(g)+4H+(aq)+4e-
C.CH3OH(g)+H2O(1)
D.O2(g)+2H2O(1)+4e-→ 4OH-
难度: 困难查看答案及解析
-
某蓄电池放电、充电时的反应式为:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2下列推断中正确的是 ( )
①放电时,Fe为正极,Ni2O3为负极;②充电时,阴极上的电极反应式是:Fe(OH)2 +2e-→Fe+2OH-;③充电时,Ni(OH)2为阳极;④蓄电池的电极必须是浸在某中碱性溶液中。
A.①②③ B.①②④ C.①③④ D.②③④
难度: 中等查看答案及解析
-
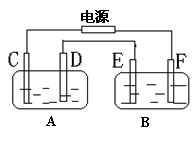 如图,A池用石墨电极电解NaOH溶液, B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法不正确的是 ( )
如图,A池用石墨电极电解NaOH溶液, B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24L。下列说法不正确的是 ( )A. F极应为粗铜板材料
B. D、E两极都发生氧化反应
C. A池中碱性增强
D. B池中E极质量增加12.8g
难度: 中等查看答案及解析
-
已知(l)
=H2O(g) △H1=a kJ·
(2)
=2H2O(g) △H2=b kJ·
(3)=H2O(l) △H3=c kJ·
(4)=2H2O(l) △H4=d kJ·
下列关系式中正确的是 ( )
A. a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 困难查看答案及解析
-
已知:Fe2O3(s)+
C(s) =
CO2(g)+2Fe(s) H =+234.1 kJ·mol-1
 C(s)+O2(g) = CO2(g) H =-393.5 kJ·mol-1
C(s)+O2(g) = CO2(g) H =-393.5 kJ·mol-1 则2Fe(s)+
O2(g) = Fe2O3(s)的H是 ( )
A.-824.4 kJ·mol-1 B.-627.6 kJ·mol-1
C.-744.7 kJ·mol-1 D.-169.4 kJ·mol
难度: 中等查看答案及解析
-
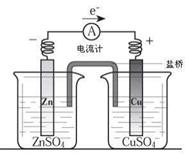
有关如右图所示原电池(盐桥中装有含琼脂的KCl饱和溶液)的叙述,正确的是 ( )
A.铜片上有气泡逸出
B.反应中,盐桥中的K+会移向CuSO4溶液
C.取出盐桥后,电流计依然发生偏转
D.反应前后铜片质量不改变
难度: 中等查看答案及解析
-
下图表示反应X(g)
4Y(g)+Z(g),H<0,在某温度时X的浓度随时间变化的曲线:
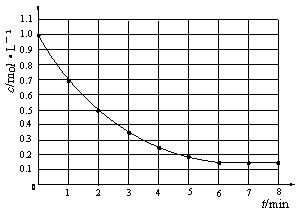
下列有关该反应的描述正确的是 ( )
A.第6 min后,反应就终止了
B.X的平衡转化率为85%
C.若升高温度,X的平衡转化率将大于85%
D.若降低温度,v (正)和v (逆)将以同样倍数减小
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移的电子的物质的量 ( )
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
难度: 困难查看答案及解析