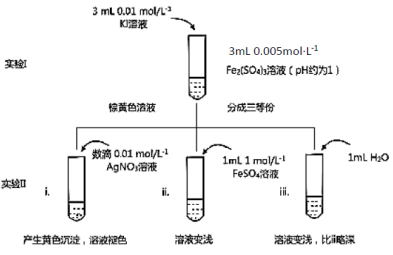
-
把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL。此时X和盐酸缓缓地进行反应,其中反应速率最大的是
A.20 mL 3 mol·L-1 的X溶液 B.20 mL 2mol·L-1 的X溶液
C.10 mL 4 mol·L-1 的X溶液 D.10 mL 2 mol·L-1 的X溶液
难度: 中等查看答案及解析
-
下列对强、弱电解质的描述,不正确的是
A.强电解质是指在水溶液中能完全电离的电解质
B.在水溶液中离子浓度小的电解质为弱电解质
C.在水溶液中只能部分电离的电解质为弱电解质
D.强酸、强碱和绝大部分盐类为强电解质
难度: 中等查看答案及解析
-
常温时,0.01 mol·L-1某一元弱酸的电离常数Ka=10-6,则下列说法正确的是
A.上述弱酸溶液的pH=4
B.加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大
C.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
D.加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,22.4 L已烷中含已烷分子数目为NA
B.28g 由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71g Na2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
难度: 困难查看答案及解析
-
已知:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1一定条件下,向体积为1L的恒容密闭容器中充入lmolCO2和3mo1H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中正确的是

A.3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
B.从反应开始到平衡,H2的平均反应速率v(H2)=0.225 mol·L-1·min-1
C.13min时,向容器中充入 2mol氦气,该反应的化学反应速率增大
D.13min时,向容器中充入 2mol CO2,该反应化学平衡常数增大
难度: 中等查看答案及解析
-
下列离子方程式 错误的是
A.向Ba(OH)2溶液中滴加稀硫酸: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2: 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
C.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
NH4++Al3++SO42-+Ba2++4OH-= BaSO4↓+Al (OH)3↓+NH3·H2O
D.铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42-
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中
 的值减小
的值减小D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
难度: 中等查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+ H2O(g)
CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A.增加压强 B.降低温度 C.增大CO 的浓度 D.更换催化剂
难度: 简单查看答案及解析
-
如图所示,甲容器容积固定不变,乙容器有可移动的活塞。甲中充入2 mol SO2和1mol O2,乙中充入4 mol SO3和1mol He,在恒定温度和相同的催化剂条件下,发生如下反应:2SO3(g)
2SO2(g)+ O2 (g)。下列有关说法正确的是

A.若活塞固定在6处不动,达平衡时甲乙两容器中的压强:P乙=P甲
B.若活塞固定在3处不动,达平衡时甲乙两容器中SO3的浓度: c(SO3)乙>2c(SO3)甲
C.若活塞固定在3处不动,达平衡时甲乙容两器中SO2的体积分数:ψ(SO2)乙>2ψ(SO2)甲
D.若活塞固定在7处不动,达平衡时两容器中SO3的物质的量分数相等
难度: 困难查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A. 在0.1 mol·L-1 NaHCO3溶液中:c(Na+) ﹥ c(HCO3-) ﹥ c(CO32-) ﹥ c(H2CO3)
B. 在0.1 mol·L-1 Na2CO3溶液中:c(OH-) – c(H+) = c(HCO3-) + c(H2CO3)
C. 向0.2 mol·L-1 NaHCO3溶液中加入等体积0.1 mol·L-1 NaOH溶液:
c(CO32-) ﹥ c(HCO3-) ﹥ c(OH-) ﹥ c(H+)
D. 常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:
c(Na+)= c(CH3COO-)> c(CH3COOH)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液反应的离子方程式为 Al3++3OH-=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.用Pt电极电解少量的MgCl2溶液:2H2O+2Cl-
H2↑+Cl2↑+2OH-
B.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+= Fe3++4H2O
难度: 困难查看答案及解析
-
下列叙述正确的是
A.稀硝酸、稀硫酸均能将木炭氧化成二氧化碳
B.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
C.Li、C、P分别在足量氧气中燃烧均生成一种相应氧化物
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
难度: 中等查看答案及解析
-
下列有关水电离情况的说法正确的是
A.25℃,pH=12的烧碱溶液与纯碱溶液,水的电离程度相同
B.其它条件不变,稀释醋酸钠溶液,水的电离程度增大
C.其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D.其它条件不变,温度升高,水的电离程度增大,Kw增大
难度: 中等查看答案及解析
-
恒温、恒压下,将1 mol O2和2 mol SO2气体充入一个体积可变的容器中(状态Ⅰ) ,发生反应:2SO2(g)+O2(g)
2SO3(g),状态Ⅱ时达平衡,则O2得转化率为:

A. 60% B. 40% C.80% D.90%
难度: 中等查看答案及解析
-
有关下列图像的分析错误的是

A.图①可表示对平衡N2(g)+3H2(g)
2NH3(g)加压、同时移除部分NH3时的速率变化。
B.图②中a、b曲线只可表示反应H2(g)十I2(g)
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③表示室温下将各1 ml pH=2的HA、HB两种酸溶液加水稀释的情况。若2<a<5,则两酸都为弱酸
D.图④中的y可表示将0.1 mol/l稀醋酸加水稀释时溶液导电能力的变化情况
难度: 困难查看答案及解析
-
已知一定条件下:A2B5(g)
A2B3(g)+B2(g) A2B3(g)
A2B(g)+B2(g)在容积为2L的密闭容器中,将4 mol A2B3加热至t℃达平衡后, A2B3浓度为0.5 mol/L,A2B5浓度为0.7 mol/L,则t℃时,B2平衡浓度是
A.0.1mol/L B. 0.2mol/L C.0.9mol/L D.1.5 mol/L
难度: 困难查看答案及解析
-
下列溶液中微粒的物质的量浓度关系一定正确的是
A.0.1mol/LNH4Cl溶液与0.05mol/LNaOH溶液等体积混合后所得的碱性溶液中:
c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
C.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)
D.某二元弱酸的酸式盐NaHA溶液:c(Na+)+ c(H+)=c(OH-)+c(HA-)+c(A2-)
难度: 困难查看答案及解析