-
根据下列反应判断有关物质还原性由强到弱的顺序是( )
①H2SO3+I2+H2O═2HI+H2SO4
②2FeCl3+2HI═2FeCl2+2HCl+I2
③3FeCl2+4HNO3═2FeCl3+NO↑+2H2O+Fe(NO3)3.
A.H2SO3>I->Fe2+>NO
B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO
D.NO>Fe2+>H2SO3>I-难度: 中等查看答案及解析
-
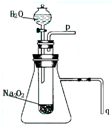
在一定温度下,向饱和的烧碱溶液中加入一定量的Na2O2,充分反应后,恢复到原来的温度,下列说法中正确的是( )
A.溶液的pH不变,有H2放出
B.溶液的pH值增大,有O2放出
C.溶液中c(Na+)增大,有O2放出
D.溶液中Na+数目减少,有O2放出难度: 中等查看答案及解析
-
下列化学方程式中,不能用离子方程式 Ba2++SO42-═BaSO4↓表示的是( )
A.Ba(NO3)2+H2SO4═BaSO4↓+2HNO3
B.BaCl2+Na2SO4═BaSO4↓+2NaCl
C.BaCO3+H2SO4═BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4═BaSO4↓+2HCl难度: 中等查看答案及解析
-
人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力.服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有( )
A.酸性
B.碱性
C.氧化性
D.还原性难度: 中等查看答案及解析
-
在0.5L某浓度的NaCl溶液中含有0.5mol Na+,下列对该溶液的说法中,不正确的是( )
A.该溶液的物质的量浓度为1mol•L-1
B.该溶液中含有58.5g NaCl
C.配制100mL该溶液需用5.85g NaCl
D.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol难度: 中等查看答案及解析
-
根据下列反应,推断盐酸应当具有的性质是( )
①Zn+2HCl=ZnCl2+H2↑ ②2HCl+CuO=CuCl2+H2O ③MnO2+4HClMnCl2+Cl2↑+H2O.
A.只有酸性
B.只有氧化性
C.只有还原性
D.有酸性、有氧化性和还原性难度: 中等查看答案及解析
-
图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2mol•L-1
B.1molZn与足量的该硫酸反应产生2gH2
C.配制200mL4.6mol•L-1的稀硫酸需取该硫酸50mL
D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2mol•L-1难度: 中等查看答案及解析
-
在3S+6KOH=2K2S+K2SO3+3H2O反应中,作氧化剂的S原子与作还原剂的S原子的物质的量之比是( )
A.1:2
B.2:1
C.1:3
D.3:1难度: 中等查看答案及解析
-
下列有关实验方法正确的是( )
A.向某溶液中加入酸化的Ba(NO3)2溶液,检验该溶液中是否含有SO42-
B.在250ml烧杯中,加入216g水和24gNaOH固体,配制的10%的NaOH溶液
C.用丁达尔现象区别FeCl3浓溶液和Fe(OH)3胶体
D.为检验酸性溶液中的Cl-和SO2-4,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液难度: 中等查看答案及解析
-
下列关于强、弱电解的说法中正确的是( )
A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.CO2的水溶液能导电,本身又是化合物,所以它是电解质难度: 中等查看答案及解析
-
将NaClO3和Na2SO3按物质的量比2:1加入烧瓶中,再滴入少量H2SO4溶液并用水溶解、加热,产生棕黄色气体X,反应后测得NaClO3和Na2SO3恰好完全反应.则X为( )
A.ClO2
B.Cl2O
C.Cl2
D.Cl2O3难度: 中等查看答案及解析
-
标准状况下,mg气体A与ng气体B所含分子数相同,下列说法不正确的是( )
A.A与B相对分子质量之比为m:n
B.同质量的A与B所含分子数之比为n:m
C.相同状况下,同体积的A与B的质量之比为m:n
D.标准状况下,A与B的密度之比为n:m难度: 中等查看答案及解析
-
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2.其反应原理为:C3N3(OH)3
3HNCO;8HNCO+6NO2
7N2+8CO2+4H2O
下列说法正确的是( )
A.C3N3(OH)3与HNCO为同一物质
B.HNCO是一种很强的氧化剂
C.1molNO2在反应中转移的电子为4mol
D.反应中NO2是还原剂难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
①亚硫酸钠溶液中加入硝酸:SO32-+2H+=H2O+SO2↑
②铜片跟浓硝酸反应:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
③向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O
④0.1molFeBr2中通入0.1mol Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-.
A.①②③
B.②③
C.①④
D.③④难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
A.Na2O2在反应中只作氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.O2是氧化产物
D.2molFeSO4发生反应时,共有10mol电子转移难度: 中等查看答案及解析
-
下列各组物质中,每种物质都既能被氧化又能被还原的是( )
A.FeCl2、Cl2、CuSO4
B.Cl2、Al、H2
C.H2S、HCl、H2O2
D.F2、K、HCl难度: 中等查看答案及解析
-
将a g CuO和Fe2O3的混合物分成两等份,向其中一份中加入b mL c mol/L的稀硫酸正好完全反应;另一份在加热的条件下用H2还原,反应完全时用去H2dL(折算成标准状况).则d等于( )
A.22.4bc×10-3
B.44.8bc×10-3
C.22.4(3a-4bc×10-3)
D.22.4(3a-4bc)×10-3难度: 中等查看答案及解析
-
下列有关溶液的叙述,正确的是( )
A.室温时饱和的二氧化碳水溶液,冷却到0℃时会放出一些二氧化碳气体
B.20℃,100g水可溶解34.2gKCl,此时,KCl饱和溶液的质量分数为34.2%
C.将60℃下饱和的澄清石灰水降温到常温,会出现浑浊
D.让一束光线通过淀粉胶体,会产生丁达尔现象难度: 中等查看答案及解析
-
下列离子在指定溶液中一定能大量共存的是( )
①加入Al能放出H2的溶液中:Fe2+、Al3+、NO3-、Cl-、S2-
②在PH=11的溶液中:Na+、[Al(OH)4]-、NO3-、S2-、SO32-
③由水电离的c(H+)=10-12mol•L-1的溶液中:Cl-、HCO3-、NO3-、NH4+、F-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-.
A.②④
B.①②④
C.①③④
D.①②难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法中正确的是:( )
①18gD2O含有的电子数为10NA ②同温、同压下,相同体积的氟气和氩气所含的原子数相等 ③标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA ④在标准状况下,22.4LSO3的物质的量为1mol ⑤4℃时5.4mL的水所含的原子总数为0.9NA ⑥0.1molOH-含NA个电子 ⑦1molNa2O2与水完全反应时转移电子数为2NA.
A.③⑤⑥⑦
B.③⑤⑥
C.①②④⑦
D.③④⑤⑥难度: 中等查看答案及解析