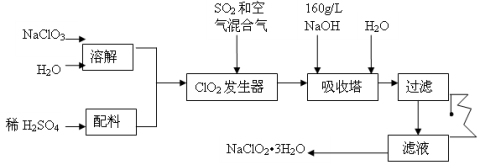
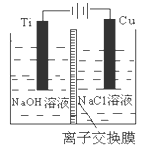
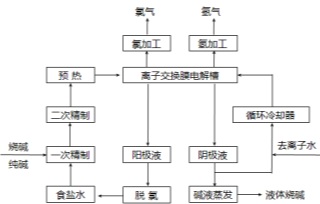
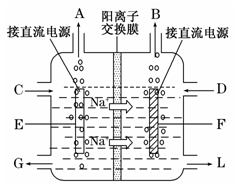
-
相同质量的钠在下列情况下产生氢气最多的是
A.放在足量水中
B.放在足量盐酸中
C.放在足量CuSO4溶液中
D.用刺有小孔的铝,包好放入足量水底中
难度: 中等查看答案及解析
-
下列叙述正确的是
A.两原子如果核外电子排布相同,则一定属于同种元素
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.ⅠA族与ⅦA族元素间只能形成离子化合物
D.非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
难度: 中等查看答案及解析
-
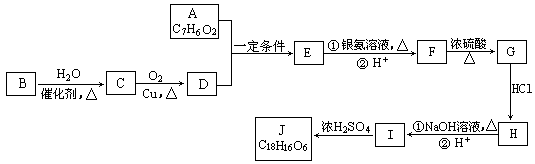
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法不正确的是
A.原子半径的大小顺序为W>Q>Z>X>Y
B.元素X的气态氢化物与Q的单质可发生置换反应
C.元素X与Y可以形成5种以上的化合物
D.元素Q的最高价氧化物对应的水化物酸性比W的强
难度: 中等查看答案及解析
-
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素
Ce、
Ce、
Ce、
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+8HI=2CeI4+4H2↑。
难度: 中等查看答案及解析
-
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12如图是向10mLAgNO3溶液中逐渐加入0.1 mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线)。根据图象所得下列结论正确的是(提示:KspAgCl>KspAgI)

A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B.图中x点的坐标为(10,6 )
C.图中x点表示溶液中Ag+ 与Cl— 浓度相同
D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1NaI则图象在终点后变为虚线部分
难度: 中等查看答案及解析
-
2011年9月23日,中国科学家屠呦呦获得了美国拉斯克医学奖的临床医学奖,获奖理由是“因为发现青蒿素——一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。下图是青蒿素的结构,则有关青蒿素的说法中不正确的是:
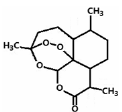
A.青蒿素分子式为C15H22O5
B.青蒿素有—O—O—键具有较强的氧化性
C.青蒿素易溶于水、乙醇、苯
D.青蒿素在碱性条件下易发生水解反应
难度: 中等查看答案及解析