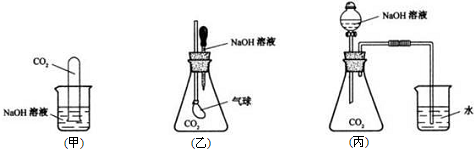
-
下列实验操作中正确的是( )
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴难度: 中等查看答案及解析
-
下列有关氧化还原反应的叙述正确的是( )
A.金属单质在氧化还原反应中只能作还原剂,非金属单质只能作氧化剂
B.化合物中某元素处于最高价只能被还原
C.失电子越多的还原剂,其还原性越强
D.某元素在反应中由化合物转化为单质,该元素一定被氧化难度: 中等查看答案及解析
-
下列反应不能用离子方程式H++OH-=H2O表示的是( )
A.硝酸与Ba(OH)2溶液
B.澄清石灰水与盐酸
C.NaOH与NaHSO4溶液
D.硫酸与Ba(OH)2溶液难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.硝酸银溶液与铜反应:Cu+Ag+=Cu2++Ag
B.氧化铜与盐酸反应:O2-+2H+=H2O
C.碳酸钡与盐酸反应:CO32-+2H+=H2O+CO2↑
D.Cu(OH)2加入H2SO4溶液中:2H++Cu(OH)2=Cu2++2H2O难度: 中等查看答案及解析
-
下列离子能大量共存的是( )
A.无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32-
B.无色透明的溶液中:Cu2+、K+、SO42-、NO3-
C.含有大量Ba(NO3)2的溶液中:Mg2+、NH4-、SO42-、Cl-
D.紫色石蕊试液呈红色的溶液中:Ca2+、K+、CO32-、NO3-难度: 中等查看答案及解析
-
下列反应中,电子转移方向和数目正确的是( )
A.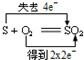
B.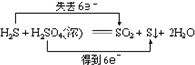
C.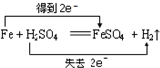
D.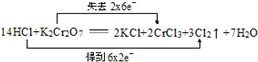
难度: 中等查看答案及解析
-
关于O2与O3气体,下列比值一定为2:3的是( )
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度和压强相同,两种气体的密度之比
C.若两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比难度: 中等查看答案及解析
-
已知NaHCO3溶液和NaOH溶液反应的离子方程式为:HCO3-+OH-=CO32-+H2O,NaHCO3在水中的电离方程式为:NaHCO3=Na++HCO3-,下列离子方程式不正确的是( )
A.Ba(HCO3)2溶液和硫酸混合:Ba2++SO42-+2H++2HCO3-=BaSO4↓+2H2O+2CO2↑
B.Ba(HCO3)2溶液和Ba(OH)2溶液混合:Ba2++H-+HCO3-=BaCO3↓+H2O
C.等体积、等浓度Ca(HCO3)2溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.等体积、等浓度Ba(OH)2溶液和NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+H2O难度: 中等查看答案及解析
-
同温同压下,在两个密闭容器中分别充有质量相同的甲、乙两种气体,且甲的密度大于乙的密度.则下列说法正确的是( )
A.甲的物质的量比乙的物质的量少
B.甲气体所占体积比乙气体所占体积大
C.甲相对分子质量比乙相对分子质量小
D.甲气体摩尔体积比乙的气体摩尔体积小难度: 中等查看答案及解析
-
已知氧化还原反应发生的条件是:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物.又已知还原性强弱顺序是I->Br->Fe2+>Cl-氧化性Cl2>Fe3+>Br2>I2),下列反应的化学方程式或叙述不成立的是( )
A.Br2+2HI=I2+2HBr
B.2FeCl2+Cl2=2FeCl3
C.2FeCl2+2HCl+I2=2FeCl3+2HI
D.Cl2通入到NaBr和NaI的混合溶液中:Cl2优先氧化I-难度: 中等查看答案及解析
-
下列说法正确的是( )
A.MnO2+4HClMnCl2+Cl2↑+2H2O中,氧化剂和还原剂物质的量之比为1:4
B.2H2S+SO2=3S+2H2O中,氧化产物和还原产物的物质的量之比为1:1
C.3S+6KOH=2K2S+K2SO3+3H2O中,被氧化和被还原的硫元素的物质的量之比为2:1
D.5NH4NO3=4N2↑+2HNO3+9H2O中,发生氧化反应和发生还原反应的氮元素的物质的量之比为5:3难度: 中等查看答案及解析
-
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A.0.1(b-2a)mol/L
B.10(2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L难度: 中等查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c moL/L,则下列关系中不正确的是(溶质用NH3表示)( )
A.ρ=
B.ω=
C.c=
D.ω=难度: 中等查看答案及解析
-
P4剧毒,不小心沾到皮肤上可以用CuSO4溶液解毒,反应为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4,下列说法正确的是( )
A.P4是还原剂,CuSO4是氧化剂
B.1molP4可还原mol的P4
C.被氧化的P4和被还原的P4的质量比为5:6
D.0.6molCuSO4可氧化0.11mol的P4难度: 中等查看答案及解析
-
35.2g FeS与1000mL 1.3mol/L硝酸溶液恰好完全反应,反应后氧化产物为Fe2 (SO4)3和Fe(NO3)3,则硝酸的还原产物为( )
A.N2
B.N2O
C.NO
D.NO2难度: 中等查看答案及解析
-
下列关于分散系的叙述不正确的是( )

A.胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
B.用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C.把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D.题干中的图片显示的是树林中的晨曦,该现象与丁达尔现象有关难度: 中等查看答案及解析
-
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗.只应用上述仪器或用品,不能进行的实验操作是( )
A.蒸发
B.萃取
C.过滤
D.蒸馏难度: 中等查看答案及解析
-
除去括号内杂质所用试剂和方法不正确的是( )
A.Fe(Al)--氢氧化钠溶液,过滤
B.KNO3(NaCl)--结晶
C.水(NaCl)--蒸馏
D.CO2(HCl)--氢氧化钠溶液,洗气难度: 中等查看答案及解析
-
下列溶液中,溶质的物质的量浓度为1mol•L-1 的是( )
A.将40gNaOH溶于1L水所得的溶液
B.将0.5mol•L-1的NaNO3溶液100mL加热蒸发掉50g水所得的溶液
C.将31gNa2O溶于水并配成1L的溶液
D.含K+为1mol•L-1的K2SO4溶液难度: 中等查看答案及解析
-
下列交叉分类法正确的是( )
A.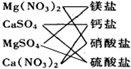
B.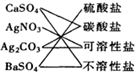
C.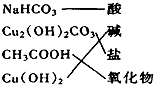
D.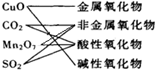
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,如果ag某双原子分子气体的分子数为P,则bg该气体在标准状况下的体积V(L)是( )
A.
B.
C.
D.难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移4NA个电子
B.100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA
C.常温常压下,6gO2和26gO3混合气体中的原子总数为2NA
D.标准状况下,2.24LCCl4所含的原子数为0.5NA难度: 中等查看答案及解析
-
若以w1和w2分别表示物质的量是浓度为c1 mol•L-1和c2mol•L-1硫酸溶液的质量分数,已知2w1=w2,则下列推断正确的(硫酸的密度比纯水的大)( )
A.2c1=c2
B.2c2=c1
C.c2>2c1
D.c1<c2<2c1难度: 中等查看答案及解析