-
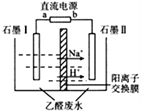
钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2,含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。
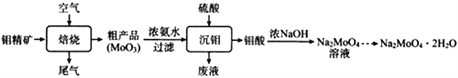
回答下列问题
(1)完成下列反应:_____MoS2+ _____O2 _____SO2+ _____MoO3
_____SO2+ _____MoO3
在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是__________________。
(2)浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为____________________________;该反应说明MoO3______(填“有”或“没有”)酸性氧化物的性质。
(3)常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则 =_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩,
=_______(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩, 将_________(填“变大”“不变”或“变小”)。
将_________(填“变大”“不变”或“变小”)。
(4)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为_____________。
| 温度(℃) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
| 析出物质 | Na2MoO4·10H2O | Na2MoO4·2H2O |
| 溶解度 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45. |
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是_____________。
(5)空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。
A. NaNO2 B.通入适量N2 C.油脂 D.盐酸
-
亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g) 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
| 序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
| 序号 | 热化学方程式 | 平衡常数 |
| ① | 2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ/mol NaNO3(s)+NOCl(g) ΔH1=a kJ/mol | K1 |
| ② | 4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol | K2 |
| ③ | 2NO(g)+Cl2(g) 2NOCl(g) ΔH3 2NOCl(g) ΔH3 | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

-
氨基甲酸铵(NH2COONH4)是重要的氨化剂,分解温度40℃,遇水水解为碳酸氢铵。某研究小组欲探究NH2COONH4的制备与性质。
Ⅰ.实验室制备NH2COONH4
反应原理:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。

(1)装置A中发生的化学反应方程式为__________________________________。
(2)上述装置的连接顺序为A→_____→_____→______;D装置所盛放的试剂为__________,C中三角漏斗的作用是________________________。
Ⅱ.制备实验的改进
(3)有人提出利用下列装置代替聚氯乙烯薄膜反应器。

该装置的优点是_______________、________________。结合化学反应方程式解释不能用水代替CCl4的原因是________________;当大量固体物质悬浮于CCl4上时即可停止反应,分离出产品的方法是______________。
Ⅲ.对NH2COONH4产物成分的探究
(4)已知,制备过程中因温度控制不当,在150℃时会产生尿素。如果对参加反应的气体干燥不彻底可能会有NH4HCO3、(NH4)2CO3杂质生成。
①请设计简单实验方案探究上述产物中是否有尿素_______________________。
②请设计定量实验方案探究上述产物(假设不存在NH4HCO3)中是否有碳酸铵___________________。
(以上方案均不需详细描述实验步骤,限用试剂:蒸馏水、Ba(OH)2溶液;仪器自选)
-
铁是重要的工业元素。
(1)铁元素位于周期表中的___________区,Fe的外围电子排布的轨道表示式为_____,Fe的7个能级中能量最高的是__________________。
(2)(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为______________。写出一种与SO42-互为等电子体的分子的化学式__________________。
(3)金属Fe具有导电性,温度越高其导电性越____________,其原因是__________________。
(4)ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有_________________(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键____________________。
(5)某种磁性氮化铁的结构如图所示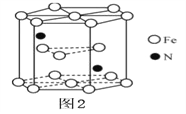 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
,则该化合物的化学式为_____________。 其中铁原子最近的铁原子的个数为_________________;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为__________g·cm-3(用含a、c和NA的计算式表示)。
-
E是一种环保型塑料,其合成路线如下:

已知:①
②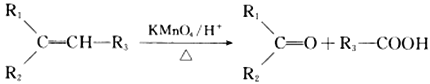 (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)
请回答下列问题:
(1)A中官能团的名称是____________,检验该官能团的试剂为___________________。
(2)反应①的化学方程式是:______________________________,其反应类型为________________,在反应①中,还可以得到另一种分子式为C10H16的化合物,其结构简式为___________________。
(3)已知,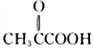 名称为丙酮酸,则C的系统命名法命名应为____________________。
名称为丙酮酸,则C的系统命名法命名应为____________________。
(4)写出反应④的化学方程式:______________________________。
(5)C的同分异构体X满足下列条件:
①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有________种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为________________。
(6)参照E的上述合成路线,设计一条由4一甲基一3一戊酮酸为起始原料制备 的合成路线(无机试剂任选)_________________________________________。
的合成路线(无机试剂任选)_________________________________________。
=1×1012的溶液中:NH4+、Na+、CO32-、SiO32-




 ,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为
,Fe为____________堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为

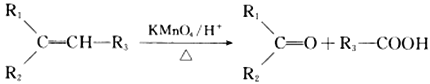 (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)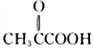 名称为丙酮酸,则C的系统命名法命名应为____________________。
名称为丙酮酸,则C的系统命名法命名应为____________________。 的合成路线(无机试剂任选)_________________________________________。
的合成路线(无机试剂任选)_________________________________________。