-
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br-,然后Br+首先与CH2=CH一端碳原子结合,第二步才是Br-与另一端碳原子结合.根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A.BrCH2CH2Br
B.ClCH2CH2Cl
C.BrCH2CH2I
D.BrCH2CH2Cl难度: 中等查看答案及解析
-
化学与生活、环境、社会等密切相关.下列说法正确的是( )
A.凡含有食品添加剂的食物对人体健康都有害,不可食用
B.棉、丝、毛及合成纤维完全燃烧都只生成H2O和CO2,对环境不会有影响
C.我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染”和节约资源
D.三聚氰胺(C3H6H6)是引起婴幼儿因食用“三鹿牌”奶粉而患泌尿系统结石病症的元凶,它不属于有机物难度: 中等查看答案及解析
-
下列各项中的表达正确的是( )
A.含1个中子的氦原子为:12He
B.四氯化碳的电子式:
C.H2O的路易斯式为:
D.乙醛的结构简式为:CH3COH难度: 中等查看答案及解析
-
下列关于盐的反应规律的说法中不正确的是( )
①盐和酸反应一定生成另一种盐和另一种酸 ②盐和碱反应一定生成另一种盐和另一种碱 ③两种盐反应一定生成另外两种盐 ④阳离子相同的两种盐一定不能发生反应.
A.只有②
B.只有③
C.只有①④
D.①②③④难度: 中等查看答案及解析
-
现有三组混合液:①乙酸乙酯和乙酸钠溶液;②乙醇和水;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、蒸馏、萃取
B.萃取、蒸馏、分液
C.分液、萃取、蒸馏
D.蒸馏、萃取、分液难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.在含有NA个CH3COO-的醋酸溶液中,H+数目略大于NA
B.28g SiO2中含有的Si-O键个数为NA
C.2.9g 熟石膏含有的结晶水分子数为0.02NA
D.在标准状况下,2.24L的CCl4中含有C-Cl键的数目约为0.4NA难度: 中等查看答案及解析
-
关于工业生产的下列叙述中,不正确的是( )
A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.工业上用离子交换膜法电解饱和食盐水制烧碱
D.工业上采用电解熔融氯化铝的方法制取金属铝难度: 中等查看答案及解析
-
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量Na2SO4后进行电解,电解过程中产生的Cl2在弱碱性条件下生成ClO,把二价镍氧化成三价镍.以下说法正确的是( )
A.可用铁做阳极材料
B.阳极反应方程式为:2Cl-2e-=Cl2↑
C.电解过程中阳极附近溶液的pH升高
D.1 mol二价镍全部转化成三价镍时,外电路中通过了2mol电子难度: 中等查看答案及解析
-
下列溶液中的各组离子能大量共存的是( )
A.pH=2的溶液中:Ca2+、ClO-、Na+、SO32-
B.c(H+)=1.0×10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-
C.由水电离产生的c(H+)=10-13mol/L的溶液中:Fe2+、NH4+、NO3-、Cl-
D.无色透明的溶液中:Cu2+、Na+、SO42-、HCO3-难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是( )
A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L
C.饱和氯水中加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
D.0.2 mo1•L-1 HCl与0.1 mo1•L-1 NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-)难度: 中等查看答案及解析
-
下列各图均为检查装置气密性的方法,根据实验现象判断,其中漏气的是( )
A.
B.
C.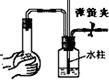
D.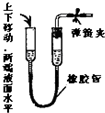
难度: 中等查看答案及解析
-
天然油脂结构的核心为甘油(HOCH2CH(OH)CH2OH),有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11).该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如下图所示(注意:图中的反应式不完整)
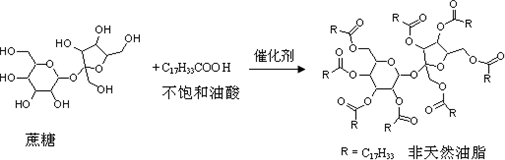
下列说法正确的是( )
A.蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质
B.该非天然油脂与氢氧化钠溶液共热,其水解产物可与溴水反应
C.非天然油脂为高分子化合物
D.该蔗糖酯在稀硫酸的作用下水解,最终可生成三种有机化合物难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.过量的铁与浓硝酸反应:Fe+6H++3NO3-=Fe3+ 十3NO2↑+3H2O
B.次氯酸钙溶液中通入过量CO2:ClO-+CO2+H2O=HClO+HCO3-
C.1mol•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O
D.在碳酸氢镁溶液中加入足量Ca(OH)2 溶液:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O难度: 中等查看答案及解析
-
对于平衡体系mA(g)+nB(g)⇌pC(g)+qD(g)△H<0.下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的要小
难度: 中等查看答案及解析
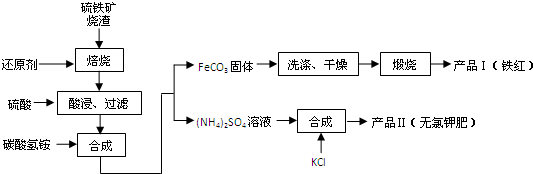
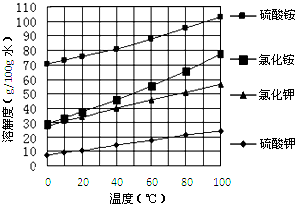
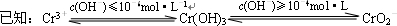 ①FeSO4还原Cr2O72-的离子方程式为______.
①FeSO4还原Cr2O72-的离子方程式为______.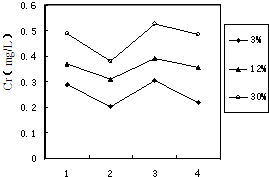
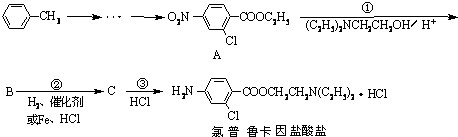
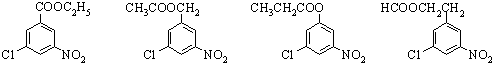

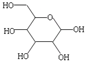 ,则葡萄糖在水溶液存在的五元环结构为______.
,则葡萄糖在水溶液存在的五元环结构为______.