-
生物质能是绿色植物通过叶绿素将太阳能固化为化学能而贮存在生物质内部的能量。江苏是全国以试验性利用生物质能最多的省份。下列说法不正确的是
A.在生物质能产业,“地沟油”是生物柴油的重要原料之一
B.生物质能具有可再生性、低污染性、广泛分布性等特点
C.生物质能资源包括:森林能源、农作物秸秆、禽畜粪便、生活垃圾
D.“生物柴油”与“柴油”的化学成分相同
难度: 简单查看答案及解析
-
Se是人体必需微量元素,下列关于
和
的说法正确的是
A.
和
互为同素异形体 B.
和
互为同位素
C.
和
分别含有44和46个质子 D.
和
都含有34个质子和中子
难度: 简单查看答案及解析
-
已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为:
 ,则下列原子中,与氧元素原子的化学性质相似的是
,则下列原子中,与氧元素原子的化学性质相似的是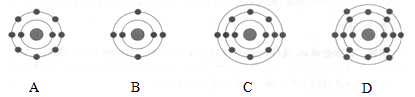
难度: 简单查看答案及解析
-
现有xMm― 和yNn+ 两种简单离子,它们的电子层结构相同。则M元素质子数的正确表达式是:
A.x=y+n+m B.x=y+n–m C. x=y–n–m D.x=y–n+m
难度: 简单查看答案及解析
-
A、B为短周期同主族的两种元素,若A的原子序数为n,则B的原子序数不可能为
A.n+16 B.n+2 C.n+8 D. n+10
难度: 简单查看答案及解析
-
已知Na、K都是第ⅠA族的元素,分别在第三周期和第四周期,下列说法正确的是:
A.原子半径Na>K B.与稀盐酸反应剧烈程度:K>Na
C.还原性Na>K D.碱性NaOH>KOH
难度: 简单查看答案及解析
-
下列物质的性质比较中,错误的是
A.熔沸点:F2<Cl2<Br2<I2 B.颜色:F2、Cl2、Br2、I2逐渐加深
C.还原性: F―>Cl―>Br―>I― D.热稳定性:HF>HCl>HBr>HI
难度: 简单查看答案及解析
-
原电池产生电流的本质原因是
A.原电池中溶液能电离出自由移动的离子]
B.有两根导线将两个活泼性不同的电极连接
C.电极上自发进行的氧化还原反应中有电子的转移
D.电极上进行的氧化还原反应的生成物为电子
难度: 简单查看答案及解析
-
对于铁—铜—稀硫酸组成的原电池装置中,当导线中有2mol电子通过时,理论上的两极变化是:①铁片溶解了28 g ②铁片减轻56g ③铜片上析出22.4L H2 ④铜片上析出1 mol H2
A.②和④ B.①和④ C.②和③ D.①和③
难度: 简单查看答案及解析
-
已知X+、Y2+、Z―、W2―四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A.原子半径:X>Y>Z>W B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X D.还原性:X>Y,W2―>Z―
难度: 简单查看答案及解析
-
下列说法正确的是
A.在共价化合物中可能存在离子键
B.只含有共价键的化合物一定是共价化合物
C.含有离子键的化合物中一定是没有共价键
D.非极性键只存在与非金属单质中
难度: 简单查看答案及解析
-
用铜片、银片、AgNO3溶液、导线构成一个原电池。以下有关该原电池的叙述正确的是:①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e―=Ag③实验过程中取出银片,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应,与该原电池总反应相同
A.①② B.②④ C.②③ D.③④
难度: 简单查看答案及解析
-
某溶液中有Na+、NH4+、Al3+、Fe2+等四种阳离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目几乎不变的阳离子是
A.Na+ B.NH4+ C.Al3+ D.Fe2+
难度: 简单查看答案及解析
-
下列说法中,不正确的是
A.若反应时形成新化学键释放的能量大于破坏旧化学键所吸收的能量,则化学反应是放热反应
B.若反应物的总能量大于生成物的总能量,则化学反应为放热反应
C.Ba(OH)2•8H2O晶体与NH4Cl固体的反应是放热反应
D.化学反应在发生物质变化的同时,一定伴随着能量的变化
难度: 简单查看答案及解析
-
化学反应的速率和限度是化工厂研究的主要问题之一。下列对化学反应速率和限度的认识正确的是:
A.决定化学反应速率的因素主要是温度、浓度、压强和催化剂
B.化学反应速率常用一段时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示
C.对于可逆反应,当进行到一定程度时,正反应和逆反应速率相等,各物质浓度相等
D.改变反应条件可以在一定程度上改变可逆反应的限度即改变该反应的化学平衡状态
难度: 简单查看答案及解析
-
足量的金属铁与下列酸溶液反应,初始反应速率最快且最终产生氢气最多的是
A.100mL0.1mol/L盐酸 B.100mL0.2mol/L硝酸
C.75 mL0.2mol/L盐酸 D.20mL18.4mol/L硫酸
难度: 简单查看答案及解析
-
甲烷是天然气的主要成分,下列有关甲烷的说法正确的是:
A.甲烷是无色、无味,密度比空气小,极难溶于水的气体
B.甲烷不能使酸性高锰酸钾溶液褪色,所以甲烷不能发生氧化反应
C.进行甲烷燃烧试验时,不一定检验其纯度
D.燃烧相同体积的天然气和管道煤气(主要成分是CO、H2),后者消耗氧气多
难度: 简单查看答案及解析
-
下列有关烷烃的说法中,正确的是
A.戊烷的同分异构体有2种,其习惯命名分别为:正戊烷、异戊烷
B.沸点:正丁烷<异丁烷
C.符合通式CnH2n+2(n≥0)的物质一定是烷烃的同系物
D.随着碳原子数的依次增加,烷烃中碳的质量分数逐渐增大,无限趋近于6/7
难度: 简单查看答案及解析
-
元素周期表里金属元素和非金属元素分界线附近能找到
A.制农药元素 B.制催化剂元素
C.制半导体元素 D.制耐高温合金元素
难度: 简单查看答案及解析
-
原子的种类决定于原子的
A.原子量大小 B.核内质子数和中子数 C.最外层电子数 D.核电荷数
难度: 简单查看答案及解析
-
含有共价键的离子化合物是
A.MgCl2 B.HBr C.N2 D.KOH
难度: 简单查看答案及解析
-
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是
A
B
C
A.Be、Na、Al B.C、Al、P
C.O、P、Cl D.B、Mg、Si
难度: 简单查看答案及解析
-
甲烷在一定条件下可以和Cl2反应。下列有关该反应的说法正确的是:①常温下,CH3Cl是气体,其他3种氯代产物都是液体 ②二氯甲烷只有一种的事实证明了CH4不是平面正方形 ③实验前可以通过排饱和食盐水的方法收集甲烷和氯气④如果把收集好甲烷和氯气的试管放在日光直射的地方,可能会发生爆炸⑤光照时,试管中甲烷和氯气的混合气体的颜色逐渐变浅,试管壁出现油状液滴,试管中有少量白雾
A.①②③④⑤ B.①②③ C.②③④ D.①②③⑤
难度: 简单查看答案及解析
-
铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42―–2e―=PbSO4 ①
PbO2+4H++SO42―+2e―=PbSO4+2H2O ②
下列有关铅蓄电池的说法不正确的是:
A.①式表示负极反应,②式表示正极反应
B.铅蓄电池的电解质溶液是硫酸溶液,在放电过程中,它的浓度逐渐降低
C.铅蓄电池在放电时,电子从Pb通过导线流向PbO2
D.铅蓄电池在充电时,原来负极发生的反应是:Pb+SO42―–2e―=PbSO4
难度: 简单查看答案及解析
-
已知拆开1mol H–H键, 1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H2
2NH3中,每生成2mol NH3,
A.放出92 kJ热量 B.吸收92 kJ热量
C.放出209kJ热量 D.吸收209kJ热量
难度: 简单查看答案及解析
-
在一定条件下,一定量的A和B气体发生如下可逆反应:A(g)+3B(g)
3C(g),只有反应到达平衡时才一定具有的性质是
A.各物质的浓度之比为1∶3∶3 B.A、B、C三种物质的浓度不随时间变化而变化
C.体系压强不随时间而改变 D.ν(A)、ν(B)、ν(C) 之比为1∶3∶3
难度: 简单查看答案及解析