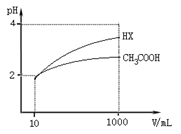
-
下列有关实验的描述不正确的是
A.钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同
B.新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气
C.次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的
D.灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应
难度: 简单查看答案及解析
-
科研、生产和生活中的下列做法,利用了氧化还原反应的是
A.用乙醚从黄花蒿中提取青蒿素
B.用氯化铁溶液腐蚀铜制印刷电路板
C.空气净化器中用活性炭层净化空气
D.用热的纯碱溶液去除油污
难度: 中等查看答案及解析
-
下列实验操作,对实验结果不会产生影响的是
A.用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH
B.测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中
C.用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂
D.在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物
难度: 中等查看答案及解析
-
化学中常借助曲线图来表示某种变化过程,如有人分别画出了下列的四个曲线图:有关上述曲线图的说法正确的是
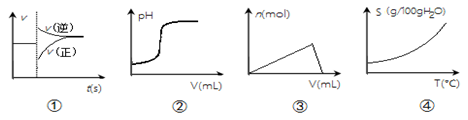
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②可以表示向一定量的硫酸溶液中滴加一定浓度的氢氧化钠溶液时pH的变化
C.图③可以表示向一定量的明矾溶液中滴加一定浓度的氢氧化钡溶液时产生沉淀的物质的量变化
D.图④可以表示所有的固体物质溶解度随温度的变化
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀 H2SO4 中滴加少量 Cu(NO3)2 溶液
B.N2(g)+3H2(g)
2NH3(g) ΔH<0,其他条件不变时升高温度,平衡时氢气转化率增大
C.吸热反应“TiO2(s)+2Cl2(g)
TiCl4(g)+O2(g)”在一定条件下可自发进行,则该反应的ΔS<0
D.在稀AgNO3溶液中加入过量 NaCl溶液,产生白色沉淀,再加入少量 Na2S溶液,出现黑色沉淀,则加入Na2S溶液后 c(Ag+) 更小了
难度: 中等查看答案及解析
-
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是

A. Mg电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH增大
D. 溶液中Cl-向正极移动
难度: 中等查看答案及解析