-
(2013年四川)下列物质分类正确的是( )
A.SO2、SiO2、CO均为酸性氧化物 B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.烧碱、冰醋酸、四氯化碳均为电解质 D.福尔马林、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
下列逻辑关系图中正确的是( )
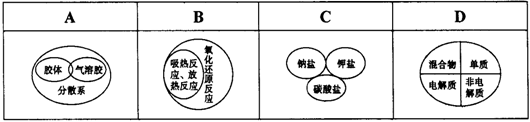
难度: 中等查看答案及解析
-
分类是学习和研究化学的一种常用的科学方法,下列分类正确的是( )
① 根据一个酸分子电离产生氢离子的个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④ 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素
⑤ 根据反应的热效应将化学反应分为放热反应和吸热反应
A.①②③ B.①②⑤ C.①②④ D.③④⑤
难度: 中等查看答案及解析
-
下列与含氯化合物有关的说法正确的是( )
A.HC1O是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4LH2(标况),理论上需要转移NA个电子(NA阿伏加德罗常数)
难度: 中等查看答案及解析
-
下列物质的分类结果全部正确的是( )
A.NO2—酸性氧化物 Na2O2—碱性氧化物 A12O3—两性氧化物
B.汽油―混合物 胆矾―纯净物 HD—单质
C.苏打-碱 硫化氢―酸 小苏打―酸式盐
D.液氯―非电解质 硫酸钡―强电解质
难度: 中等查看答案及解析
-
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体。下列说法中正确的是( )
A.所得的分散系属于悬浊液 B.该分散系能产生丁达尔效应
C.所得的分散系中分散质为Fe2O3 D.分散系为胶体,且胶粒直径即Fe(OH)3分子直径
难度: 中等查看答案及解析
-
下列有关分类的观点正确的是( )
A.HD、NaOH都属于化合物
B.碳素钢、不锈钢和目前流通的硬币都属于合金
C.浓盐酸、浓硫酸、浓硝酸都属于氧化性酸
D.氨水、醋酸、氢氧化铝都属于弱电解质
难度: 中等查看答案及解析
-
40℃时,将等质量的两份饱和澄清石灰水,一份冷却到10℃;另一份中加入少量氧化钙,温度仍控制在40℃。则在这两种情况下,下列量相同的是( )
A.Ca(OH)2的溶解度 B.溶液的质量
C.溶液中Ca2+的数目 D.溶液中溶质的质量分数
难度: 中等查看答案及解析
-
一定量14%的KOH溶液,若将其蒸发掉100g水后,其质量分数恰好增大一倍,变为28%,体积为125mL,则浓缩后的KOH溶液物质的量浓度为( )
A.2mol/L B.4 mol/L C.5 mol/L D.6.25 mol/L
难度: 中等查看答案及解析
-
【双选】将淀粉-KI混合溶液放在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取杯中液体进行实验,能证明半透膜破损的是()
A.加碘水变蓝色 B.加碘水不变蓝色
C.加AgNO3溶液产生黄色沉淀 D.加入氯水变蓝色
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.光导纤维、石英、硅胶分别属于单质、酸性氧化物、酸
B.Na、Al、Cu可以分别用热还原法、热分解法和电解法冶炼得到
C.氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质
D.天然气、沼气和液化石油气分别属于化石能源、不可再生能源和二次能源
难度: 中等查看答案及解析
-
【双选】在热水中比冷水中溶解得较少的物质是( )
A.苯酚 B.消石灰 C.淀粉 D.干冰
难度: 简单查看答案及解析
-
现有100g浓度为16%的某盐溶液,若将其浓度增大一倍,可采用的方法是( )
A. 把溶剂蒸发一半 B. 把溶液质量减少一半
C. 蒸发溶剂质量等于原溶液质量的一半 D. 在原溶液中加入50g溶质
难度: 简单查看答案及解析
-
下列过程均有沉淀生成,属于化学变化的是( )
A.向蛋白质溶液中加入浓氯化钠溶液
B.两种不同品牌的墨水混合
C.向饱和BaSO4溶液中加入浓BaCl2溶液
D.向饱和Na2CO3溶液中通入CO2气体
难度: 简单查看答案及解析
-
【双选】t℃,取相同浓度KNO3溶液150g和75g,各蒸发20g水,分别析出mlg和m2g晶体,则m1与m2的关系可能为( )
A.ml>m2 B.ml<m2 C.ml=m2 D.以上均有可能
难度: 简单查看答案及解析
