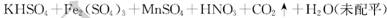-
2011年是国际化学年.中国的宣传口号是“化学——我们的生活.我们的未来”。下列有关叙不正确的是
A. 在家用燃煤中加人适量的生石灰能有效减少二氧化硫的排放量
B. 利用太阳能、潮汐能、风力发电,以获取清洁能源
C. 采用纳米二氧化钛光触媒技术.将汽车尾气中的NO和CO转化为无害气体
D. 大量排放SO2,NO2或CO2都会导致酸雨的形成
难度: 中等查看答案及解析
-
下列有关物质的表述中正确的是
A.次氯酸的电子式:
B.中子数为8的氮原子:
C.
的结构示意图:
D.钾长石的化学式:
难度: 中等查看答案及解析
-
下列关于Cl、N、S、Si等非金属元素的单质或化合物的说法错误的是
A. 硅是制造太阳能电池的常用材料
B. NO、SiO2 ,SO3都可通过化合反应生成
C. 实验室可用NaOH溶液处理Cl2和SO2废气
D. 实验室可用浓硫酸干燥氨气
难度: 中等查看答案及解析
-
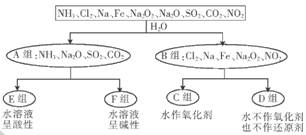
稀土元素是宝贵的战略资源.我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素.在稀土混合溶液中加人H2O2,调节
转变为
沉淀得以分离。其反应的化学方程式可表示为
(未配平)。下列对该反应的说法不正确的是
A. X为
B. H2O2为氧化剂
C. 该反应属于非氧化还原反应
D. 该反应中每生成52g
,转移电子的物质的量为0. 25 mol
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.
的氨水中
和
的总数为
B. 1 mol Na2O2与足量H2O充分反应,转移的电子数为2NA
C. 0.1 mol Cu与足量浓硫酸反应生成SO2的体积约为4.48 L
D. 常温常压下,21g氧气和27 g臭氧所含的氧原子总数为3NA
难度: 中等查看答案及解析
-
在两个容积相同的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.质子数 B.原子数 C.密度 D.质量
难度: 中等查看答案及解析
-
下列粒子在相应条件下可大量共存的是
A. 常温常压下混合气体:
B. 碱性溶液中:
C. 酸性溶液中:
D. 含有
的溶液中:
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 向硫酸铝溶液中加人过量氨水:
B. 将
溶于过量的稀硝酸:
C. 用次氯酸钠溶液吸收过量的
D. 向
溶液中加人硫酸:
难度: 中等查看答案及解析
-
下列说法正确的是
A.根据反应
可知:用酸性KMnO4溶液可检验绿矾
是否变质
B.根据反应
可知:反应中HNO3表现酸性和氧化性
C. 根据反应
可知:
的酸性比
强
D. 根据反应
可知:
属于三元酸
难度: 中等查看答案及解析
-
将SO2通入BaCl2溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)

A.大理石和稀盐酸 B. CaO和浓氨水
C. Cu和浓硝酸 D. MnO2和双氧水
难度: 中等查看答案及解析
-
某反应体系中的物质有
,已知Zn是反应物,下列说法错误的是
A. 反应中氧化剂与还原剂的物质的量之比为14:5
B. 反应中还原剂与氧化产物的物质的量之比为1:1
C. 若1mol Zn参与反应.则转移的电子数约为
D. 若把该反应设计成原电池,则负极的电极反应式为
难度: 中等查看答案及解析
-
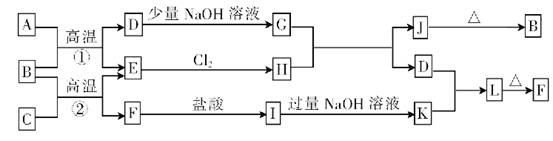
下列各组物质按如图所示转化关系每一步都能一步实现的是
 ^
^
难度: 中等查看答案及解析
-
如图是课外活动小组同学设计的4个喷泉实验方案.下列有关操作不可能引发喷泉现象的是

A. 挤压装置①的胶头滴管使CCl4全部进人烧瓶,片刻后打开止水夹
B. 挤压装置②的胶头滴管使NaOH溶液全部进人烧瓶.片刻后打开止水夹
C. 用鼓气装置从装置③的a处不断鼓人空气并打开止水夹
D. 向装置④的水槽中慢慢加人足量浓硫酸并打开止水夹
难度: 中等查看答案及解析
-
向mg镁和铝的混合物中加人适量的稀硫酸.恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加人
的氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将所得沉淀灼烧至质量不再改变为止,得到固体p g0则下列关系不正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析