-
分类是学习和研究化学的一种常用的科学方法。下列6项分类中合理的有几项 ( )
①根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数的多少将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
⑥根据分散剂的直径大小,分散系可分为溶液、胶体和浊液
A.1项 B.2项 C.3项 D.4项
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列4项叙述中正确的有几项 ( )
①106 g Na2CO3晶体中的离子总数大于3NA
②标准状况下,16gO3和O2混合气体中含有的氧原子数为NA
③将FeCl3的饱和溶液(含FeCl3 0. 1mol)加入沸水中充分作用制成胶体,其中含有胶体粒子的数目为0.1NA
④1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.1项 B.2项 C.3项 D.4项
难度: 中等查看答案及解析
-
下列5项内容中,排列顺序正确的有几项 ( )
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②相同物质的量浓度的下列溶液中NH4+ 的浓度:(NH4)2SO4>(NH4)2CO3>NH4Cl
③微粒半径:K+>S2->F
④给出质子的能力:CH3COOH>C2H5OH>H2O
⑤氢化物的沸点:HI>HCl>HF
A.1项 B.2项 C.3项 D.4项
难度: 中等查看答案及解析
-
将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是 ( )
选项
氯水滴入下列溶液中
实验现象
结论
A
滴有KSCN的FeCl2溶液
变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液
褪色
Cl2具有酸性
C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
D
KI淀粉溶液
变蓝色
Cl2具有氧化性
难度: 中等查看答案及解析
-
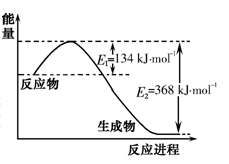
25℃、101kPa下,反应2N2O5(g)=4NO2(g)+O2(g) △H=+56.7kJ/mol能自发进行的原()
A.是吸热反应 B.是放热反应
C.是熵减小的反应 D.熵增效应大于热效应
难度: 中等查看答案及解析
-
已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是 ( )
A.反应中硫酸作氧化剂 B.NH4CuSO3中硫元素被氧化
C.1molNH4CuSO3完全反应转移0.5mol电子
D.刺激性气味的气体是氨气
难度: 中等查看答案及解析
-
对照实验是研究物质性质的一种重要方法,下列不是用来做对照实验的是 ( )

难度: 中等查看答案及解析
-
下述实验不能达到预期实验目的的是 ( )
序号
实验内容
实验目的
A
将2.5g CuSO4·5H2O溶解在97.5g 水中
配制质量分数为1.6%的CuSO4溶液
B
向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液
说明一种沉淀能转化为另一种溶解度更小的沉淀
C
室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
D
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是 ( )
A.将Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+=Fe3++3H2O
B. NaHCO3溶液水【解析】
HCO3-+H2OCO32-+H3O+
C.用浓硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D .向Ba(HCO3)2溶液中加入少量的NaOH溶液 Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是 ( )
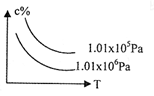
A.△H<0 △S>0
B.△H>0 △S<0
C.△H>0 △S>0
D.△H<0 △S<0
难度: 中等查看答案及解析
-
现有H2SO4、BaCl2、K2CO3、FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应。下列推断不合理的是 ( )
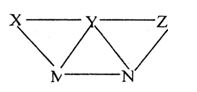
A.X一定为H2SO4
B.Y一定为K2CO3
C.Z可能是氯水
D.M可能为FeSO4
难度: 中等查看答案及解析
-
室温下某无色透明溶液中由水电离出的H+和OH—浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为( )
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+ D.SiO32-、OH-、SO32-、Na+、Cl-
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
已知0.01mol/l 二元酸H2A溶液的PH=4,下列说法正确的是
A.在Na2A,NaHA两种溶液中,离子种类不相同
B.在溶质的物质的量相等的Na2A,NaHA两种溶液中,阴离子总数相等
C.在NaHA溶液中一定有c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.在Na2A溶液中一定有C(H+)+ c(HA-)= c(OH-)-2C(H2A)
难度: 中等查看答案及解析
-
已知N2(g) +3H2(g)
2NH3(g) △H=-92.4kJ/mol。在一恒温恒压的密闭容器里充入2 mol N2和8 mol H2达到平衡时生成1 mol NH3。现在相同条件下的同一容器中充入xmol N2,ymol H2和2molNH3,达到平衡时,NH3的质量分数与原来相同,且放出热量46.2 kJ。则x、y的值为( )
A.1.5,6.5 B.2,8 C.5,21 D.3,13
难度: 中等查看答案及解析
-
有100 mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2 mol·L-1,c(Cl-)=1.3 mol·L-1。要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要2 mol·L-1的NaOH溶液的体积为 ( )
A.80 mL B.100 mL C.120 mL D.140 mL
难度: 中等查看答案及解析