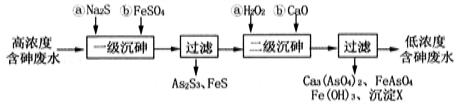
-
随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )
A.绿色化学的核心是利用化学原理从头上减少和消除工农业生产等对环境的污染
B.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水
C.大力实施矿物燃料“脱硫、脱硝技术”,减少硫和氮的氧化物对环境的污染
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物
分散在空气中形成混合物具有丁达尔效应
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2NA
B. 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA
C. 标准状况下,44.8L NO与22.4 L O2反应后的分子数是2NA
D. 27g铝中加入1mol/L的NaOH溶液,转移电子数是3NA
难度: 中等查看答案及解析
-
下列关于有机物的叙述不正确的是
A.C4H8O2的酯有4种结构
B.淀粉和纤维素互为同分异构体
C.乙醇和葡萄糖均能发生酯化反应
D.漂粉精和医用酒精均可用作消毒剂
难度: 简单查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是

A. 对应简单离子半径:X>W
B. 对应气态氢化物的稳定性Y>Z
C. 化合物XZW既含离子键,又含共价键
D. Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应
难度: 中等查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。
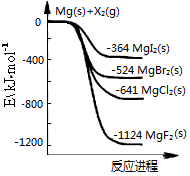
下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为:

C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:
MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
难度: 中等查看答案及解析
-
科学家用氮化镓材料与铜组装成如图所示的人工光合系
统,利用该装置成功地实现了以CO2和H2O合成CH4。下列关于该电池叙述错误的是( )
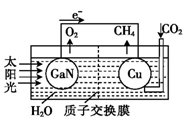
A.电池工作时,是将太阳能转化为电能
B. 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O
C.电池内部H+透过质子交换膜从左向
右移动
D.为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液
难度: 简单查看答案及解析
-
有体积相同、相等pH的烧碱溶液和氨水,下列叙述中正确的是
A. 两溶液物质的量浓度相同
B. 两溶液中OH-离子浓度相同
C. 用同浓度的盐酸中和时,消耗盐酸的体积相同
D. 加入等体积的水稀释后,pH仍相等
难度: 中等查看答案及解析

 的值等于______。(取两位有效数字)
的值等于______。(取两位有效数字)