-
位于前四周期的8种元素A、B、C、D、E、F、G、H的原子序数依次增大,其中A是所有原子中原子半径最小的,且与B同族,C的基态原子2P能级上只有1个电子,F可与A可按原子个数比1∶1和1∶2形成化合物;F与G同族,H的原子序数为29,根据上述信息描述,请回答下列问题:
(1)请写出上述8种元素中电负性最大的元素与B元素形成常见的化合物的化学式___(用具体元素符号表示的化学式),写出基态原子的第一电离能最大的元素在周期表中的位置为___。
(2)写出H的原子在基态时的核外电子排布式为_________。
(3)1mol D2A6分子(链状)中含有 键的数目为 ________。
键的数目为 ________。
(4)已知A2F2分子结构如图a所示,则其中心原子杂化轨道类型为________。

(5)判断A2F2____(填难或易)溶于DG2,并简要说明原因_____________________。
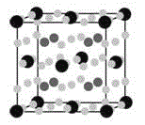
(6)C与E形成某化合物的晶胞如图 b所示,则处于晶胞顶角上的原子的配位数为_______,若该化合物的密度为 g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含
g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含 、NA的代数式表示)。
、NA的代数式表示)。
-
a、b、c、d、e是元素周期表中前四周期的元素,其原子序数依次增大,a为元素周期表中原子半径最小的元素,b的基态原子中占有电子的3个能级上的电子总数均相等,d与b同族,c与b同周期,且c的所有p轨道上的电子总数与所有s轨道上的电子总数相等,e的次外层电子数是其最外层电子的7倍。回答下列问题:
(1)c、d形成的化合物的晶体类型为___________;
(2)b、a c形成的三原子分子中,c原子的杂化方式为___________;
(3)b、c、d三种元素的电负性由小到大的顺序为___________;(用元素符号表示),d元素基态原子价层电子排布式为_________;
(4)金属Mg与a、e形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表e,深灰色小球代表Mg,浅灰色小球代表a,其中浅灰色小球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:__________________。
(5)b、c、e能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和灰色小球代表。该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
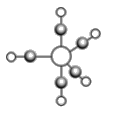

(6)①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+______________________
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似_______
-
A、B、C、D、E是元素周期表中前四周期的元素,其原子序数依次增大,A为元素周期表中原子半径最小的元素,B的基态原子中占有电子的3个能级上的电子数均相等,D与B同族,C与B同周期,且C的所有p轨道上的电子数与所有s轨道上的电子数相等,E的次外层电子数是其最外层电子的7倍。
回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为___________;(用元素符号表示),D元素基态原子价层电子排布式为______________________;
(2)A、C形成的三原子分子中,C原子的杂化方式为___________;
(3)C、D形成的化合物的晶体类型为___________;
(4)金属Mg与A、E形成的化合物是目前人类已发现的体积储氢密度最高的储氢材料之一,其晶胞结构如图所示,其中黑球代表E,灰球代表Mg,白球代表A,其中白球除在棱上、面上以外,在晶胞内部还有6个。试写出该化合物的化学式:______________________。
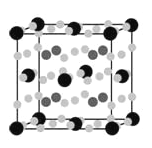
(5)B、C、E能形成如图所示三角双锥构型的配合物分子,三种元素的原子分别用大白球、小白球和黑球代表。

该配合物形成配位键时提供空轨道的原子是___________(填元素符号),该配合物中大白球代表的元素的化合价为___________。
①在水溶液中,水以多种微粒的形式与其他化合物形成水合物。试画出如下微粒的结构图式。H5O2+:______________________
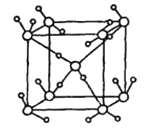
②如图为冰的一种骨架形式,依此为单位向空间延伸该冰中的每个水分子有___________个氢键;如果不考虑晶体和键的类型,哪一物质的空间连接方式与这种冰的连接类似______________________
-
已知G、W、D、E、X、Y、Z是七种短周期主族元素.G是所有元素中原子半径最小的元素,元素W与元素Y位于同一主族.X、W、E三元素位于同一周期,且原子序数依次增大.D、W在周期表中的位置如表格所示.请回答下列问题.
(1)①化合物DY2 和 DW2 的分子空间构型相似,DW2的结构式为______.
②已知元素W和E的最外层电子数之和与Y和X的最外层电子数之和相差6,都由G、W、X、Y四种元素形成的两种化合物能发生反应的离子方程式为______.
③已知aX、bY、cZ三种元素,a+b+c=26,Z的最高价氧化物的水化物与其氢化物反应生成的化合物水溶液的PH______7(填“大于”、“等于”、或“小于”);如果给溶液加热,溶液的PH______(填“增大”、“等于”、或“减小”);其变化的原因是______.
(2)化合物XZ3是合成抗禽流感药物“达菲”的中间活性物质,XZ3 受撞击会生成一种非金属单质和一种离子化合物X3Z,请写出该反应的化学方程式______.若反应生成标准状况下3.36L气体单质,则电子转移的物质的量为______.
(3)化合物A、B均由上述G、W、E、X、Y五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,若A能抑制水的电离,B能促进水的电离,则化合物A的化学式为______,B的化学式为______.
-
短周期主族元素 X、Y、Z、W的原子序数依次增大,X原子最外层电子比次外层多4个,Y、Z为相邻金属元素,Z的简单离子半径在同周期元素中最小,W与X同族。 下列说法不正确的是
A. 原子半径:Y>Z>W>X
B. 气态氢化物的热稳定性:X>W
C. 工业上常用电解对应氯化物的方法制备单质 Z
D. Y 的最高价氧化物对应的水化物可溶于氯化铵溶液
-
短周期主族元素 X、Y、Z、W的原子序数依次增大,X原子最外层电子比次外层多4个,Y、Z为相邻金属元素,Z的简单离子半径在同周期元素中最小,W与X同族。下列说法不正确的是
A.原子半径:Y>Z>W>X
B.气态氢化物的热稳定性:X>W
C.工业上常用电解对应氯化物的方法制备单质Z
D.Y的最高价氧化物对应的水化物可溶于氯化铵溶液
-
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则 ( )。
A.原子半径:乙>丁>丙
B.非金属性:丙>丁>戊
C.甲与戊形成的化合物是共价化合物
D.乙、丙、丁最高价氧化物对应的水化物均是强酸
-
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30。由上述六种元素中的几种元素组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
元素形成的化合物
化合物 甲 乙 丙
各元素原子
个数比 N(A):N(C)
=2:1 N(A):N(C)
=1:1 N(B):N(A)
=1:4
化合物 丁 戊 己
各元素原子
个数比 N(D):N(B):N(C)
=2:1:3 N(E):N(F)
=1:3 N(B):N(F)
=1:4
请完成下列问题:
(1)D的离子结构示意图为________,己的空间构型是________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为________ mol。
(3)8 g丙完全燃烧,生成液态水和CO2,放出445 kJ的热量,则丙燃烧的热化学方程式为________。
(4)F的单质与甲反应的离子方程式为________。
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为________。
-
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可 制成半导体材料,戊的最高化合价为+7,则
A.原子半径:乙>丁>丙
B.非金属性:丙>丁>戊
C.甲与戊形成的化合物是共价化合物
D.乙、丙、丁最高价氧化物对应的水化物均是强酸
-
Ⅰ(10分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子。B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍。A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物。回答下列问题:
(1)写出相应元素符号,A________ B________C________ E________
(2)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴人紫色石蕊试液溶液呈红色,则溶液中离子浓度由大到小的排列顺序为:________。
(3)将铝片和镁片插入由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为。
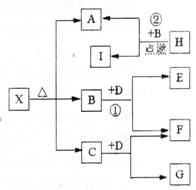 Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
试回答下列问题
(1)G的化学式为:________
(2)写出下列反应的化学方程式
①________
②________
键的数目为 ________。

g·cm-3,阿伏加德罗常数为NA,则两个最近E原子间的距离为____ pm(用含
、NA的代数式表示)。






 Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。
Ⅱ(5分)已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右图所示的关系。