-
在元素周期表中金属元素和非金属元素的分界线附近的一些元素能用于制( )
A.催化剂
B.农药
C.半导体
D.新元素难度: 中等查看答案及解析
-
2009年三位科学家万卡特拉曼•莱马克里斯南、托马斯•施泰茨和阿达•尤纳斯因为“核糖体的结构和功能”的研究而获得该年的诺贝尔化学奖.核糖体含有的元素除氮、磷等元素外,一定含有的元素是( )
A.C、H、O
B.C、Fe、H
C.C、H、Na
D.H、O、K难度: 中等查看答案及解析
-
所谓“地沟油”是从一些饭店、酒店的下水道里捞出来的残油剩渣、饭店的“泔水油”以及垃圾猪肉加工成“食用油”.制作过程:
①捞去废油中的悬浮杂质;
②加入双氧水进行漂白;
③加入工业消泡剂(内含铅、砷等元素及苯环、杂环等化合物);
④高温炼制;
⑤包装成成品油出售到不法的火锅店、饭店、工厂和学校餐厅.
以下判断正确的是( )
A.“地沟油”外观与普通食用油一样,经过以上处理的“地沟油”具有固定的熔沸点
B.“地沟油”可用来作化工原料,如制作肥皂等产品
C.“地沟油”在加入消泡剂后,消除对人体健康的影响
D.“地沟油”中主要成分是蛋白质,还含有较多微量元素难度: 中等查看答案及解析
-
下列各组微粒的半径比较中,正确的是( )
①F<F-<Cl- ②O2-<Mg2+<Al3+ ③Na+<Na<Rb ④P<S<Cl.
A.①③
B.②③
C.③④
D.①②难度: 中等查看答案及解析
-
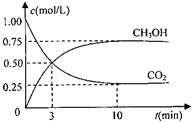
假设某化学反应的反应过程如图表示:观察分析符合图中变化的化学反应为( )
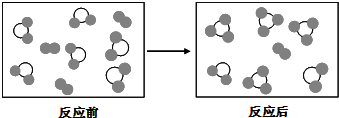
A.A2+3B2⇌2AB3
B.2AB2+B2⇌2AB3
C.2A2B+5B2═4AB3
D.2A2B+B2═2AB3难度: 中等查看答案及解析
-
以下推断或现象错误的是( )
A.离子化合物可能完全由非金属元素组成
B.邻二氯苯没有同分异构体,说明苯分子中不存在单、双键交替相连的结构
C.A、B两种金属用导线相连接浸泡在稀硫酸溶液中,形成原电池,金属A作负极,金属B表面产生气泡,但同样金属A直接与该稀硫酸溶液反应时,溶解腐蚀的速度会更快
D.在3 mL 5%的H2O2溶液中,滴加2滴1mol/L的FeCl3溶液,观察到溶液颜色由黄色变到红褐色,当溶液无气泡产生后,溶液颜色又恢复至黄色,FeCl3在催化过程中可能参加了化学反应难度: 中等查看答案及解析
-
用铝单质还原下列化合物,制得金属单质各1mol,需消耗铝最少的是( )
A.MnO2
B.WO3
C.Co3O4
D.Cr2O3难度: 中等查看答案及解析
-
如图所示,对A生成C的反应,下列所得结论正确的是( )
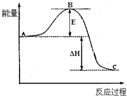
A.该反应为吸热反应
B.该反应进行时,一定有能量放出
C.A物质比C物质稳定
D.该反应肯定很容易,不需要加热就可以进行难度: 中等查看答案及解析
-
可以证明可逆反应N2(g)+3H2(g)⇌2NH3(g)已达平衡状态的是( )
①一个N≡N键断裂的同时,有3个H-H键断裂;②一个N≡N键断裂的同时,有6个N-H键断裂;③其他条件不变时,混合气体的总质量不变;④恒温恒容下的反应,体系压强不再改变;⑤反应体系中反应物和生成物的百分含量都不再改变;⑥恒温恒压下的反应,密度不再改变;⑦正反应速率v(H2)=0.6mol/,逆反应速率v(NH3)=0.4mol/
A.全部
B.②④⑤⑥⑦
C.②③④⑤⑥⑦
D.③④⑤⑥⑦难度: 中等查看答案及解析
-
工业生产中物质制备时,通过下列的反应原理一步完成获得产物,符合“绿色化学”原则的反应原理是( )
A.加成反应
B.分解反应
C.取代反应
D.置换反应难度: 中等查看答案及解析
-
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是( )
A.
海带灼烧成灰
B.
过滤得含I-溶液
C.
从下口放出碘的苯溶液
D.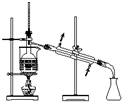
分离碘并回收苯难度: 中等查看答案及解析
-
分子中有3个-CH3的C7H16,其可能的结构有( )
A.3种
B.4种
C.5种
D.6种难度: 中等查看答案及解析
-
等物质的量的乙醇、乙烷、乙炔(C2H2)完全燃烧消耗的氧气的物质的量之比为( )
A.6:7:5
B.1:1:1
C.35:30:42
D.3:5:4难度: 中等查看答案及解析
-
巴豆酸的结构简式为CH3CH=CHCOOH,现有①水;②溴的四氯化碳溶液;③乙醇;④纯碱溶液;⑤酸性KMnO4溶液,在一定条件下能与巴豆酸反应的物质组合是( )
A.只有②④⑤
B.只有②③⑤
C.只有②③④⑤
D.①②③④⑤难度: 中等查看答案及解析
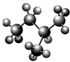 ]新戊烷[
]新戊烷[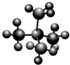 ]
]