-
下列说法不正确的是
A.研究物质的性质,常用观察、实验、分类、比较等方法;研究物质的结构,常利用模型、假说等方法
B.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
C.硅是将太阳能转化为电能的常用材料
D.先开发资源再治理环境的发展理念符合可持续发展的基本国策
难度: 简单查看答案及解析
-
下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是
A.FeCl3 B.Ca(HCO3)2 C.NaAlO2 D.Na2SO3
难度: 简单查看答案及解析
-
下列说法中正确的是
A.同一周期元素的原子,半径越小越容易失去电子
B.在同一周期中,ⅠA族单质的还原性比ⅡA族的弱
C.所有主族元素的最高化合价数与它的族序数数值相等
D.同主族元素的气态氢化物,相对分子质量越大,沸点不一定越高
难度: 简单查看答案及解析
-
已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+ 要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱 B.降低温度 C.加少量冰醋酸 D.加水
难度: 简单查看答案及解析
-
阿伏加德罗常数的近似值为6.02×1023,下列说法中正确的是
A.BaO2(过氧化钡)固体中的阳离子和阴离子个数比为1: 2
B.22.4 L的HCl溶于水,溶液中H+离子数为6.02×1023
C.1 mol CO2与含1 mol NaOH的溶液反应后,溶液中
离子数为6.02×1023[
D.Na2O2与H2O反应,常温常压下生成16 gO2,反应中转移电子数为6.02×1023
难度: 简单查看答案及解析
-
下列实验操作中,错误的是
A.配制100 g 5%的食盐溶液时,需将5 g食盐放入烧杯中,加95 mL水搅拌溶解即可
B.配制0.1 mol·L-1的硫酸溶液时,将量取的浓硫酸放入盛有水的容量瓶中稀释
C.用中和滴定方法测某NaOH 溶液的浓度,量取待测液时用该溶液润洗碱式滴定管
D.中和热测定实验中,应用环形玻璃搅拌棒轻轻搅动混合液
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:
、
、
、I―
B.常温下,pH=12的溶液中:SO32― 、Cl― 、K+ 、SiO32-
C.在pH=1的溶液中:
、
、
、
D.在无色透明溶液中:
、
、
、
难度: 简单查看答案及解析
-
-NMR(核磁共振)可用于含碳化合物的结构分析,
表示的含义错误的是
A.表示碳元素的一种同位素
B.表示碳元素的一种核素
C.质量数是13,原子序数是6,核内有7个质子
D.质量数是13,原子序数是6,核内有7个中子
难度: 简单查看答案及解析
-
由短周期的两种元素形成化合物XY3,下列说法正确的是
A.X和Y不可能位于同一周期 B.X不可能是非金属
C.X和Y一定位于不同主族 D.化合物XY3溶于水可能显碱
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和和食盐水的阳极反应:2Cl--2e-=Cl2↑
难度: 简单查看答案及解析
-
下列有关环境问题的说法不正确的是
A.将炼铁的高炉加高,以减少高炉气中CO的含量
B.在燃煤中加入生石灰可以减少废气中SO2的含量
C.废旧电池易引起重金属污染,应集中回收处理
D.氟利昂会破坏臭氧层,应减少并逐步停止生产和使用
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.向CuSO4溶液中投入一小块金属钠:
B.向溴水中通入SO2气体:
C.向Ca(ClO)2溶液中通入少量SO2气体:
D.向KAl(SO4)2溶液中滴入Ba(OH)2溶液至SO42—恰好完全沉淀:
难度: 简单查看答案及解析
-
X、Y、Z、W四种短周期元素在周期表中相对位置如表所示,Y、Z质子数之和为21,下列说法中不正确的是

A.X、Y、Z、W均为非金属元素
B.Y、Z形成的化合物为离子晶体
C.乙的阳离子与Y的阴离子电子层结构相同
D.X、Y、W的氢化物中,Y的氢化物沸点最高
难度: 简单查看答案及解析
-
下列离子检验的结论可靠的是
A.用干燥洁净的铂丝蘸取溶液,在火焰上灼烧,若火焰呈黄色,证明不含K+
B.向溶液中加入新制氯水和CCl4,振荡、静置,若上层溶液呈紫红色,证明含有I—
C.向溶液中先加入新制氯水,再加入KSCN溶液,若溶液呈血红色,证明含有Fe2+
D.向溶液中加入氢氧化钠溶液,若立即产生红褐色沉淀,证明含有Fe3+
难度: 简单查看答案及解析
-
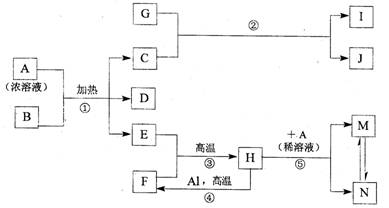
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
A.SO2的转化率为30%
B.反应共放出了196.6 kJ的热量
C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1
D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同
难度: 简单查看答案及解析
-
1943年,侯德榜先生研究成功了联合制碱法,该方法不仅提高了食盐的利用率,还在得到纯碱的同时获得了重要的副产品氯化铵。下列关于Na2CO3溶液和NH4Cl溶液的说法正确的是
A.适当升温,两溶液的pH均增大
B.常温下pH=10的碳酸钠溶液与pH=4的氯化铵溶液中水的电离程度相同
C.0.1 mol/L Na2CO3溶液中
D.0.1 mol/L NH4Cl溶液中
难度: 简单查看答案及解析
-
将一定量的镁铝合金样品分成两等份,一份加入足量NaOH溶液中,充分反应后,收集到标准状况下气体6.72L;另一份加入到足量稀盐酸中,充分反应后,收集到标准状况下气体11.2L。则原合金样品中镁的质量为
A.4.8 g B.6 g C.9.6 g D.12 g
难度: 简单查看答案及解析
-
下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-) =c(NH4+)
B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1<10c2
C.室温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈酸性
D.向冰醋酸中逐渐加水,有如图变化:a、b、c三点中水的电离程度最大的是b点
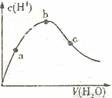
难度: 简单查看答案及解析
-
下列溶液中,微粒的浓度关系正确的是
A.0.1mol·L-1 pH为4的NaHSO3溶液中:c(HSO3―) > c(SO32―)> c(H2SO3)
B.等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F―)+c(HF)
C.在NaHA溶液中一定有:c(Na+)+c(H+) = c(HA―)+c(OH―)+c(A2-)
D.c(NH4+)相等浓度的(NH4)2CO3 、(NH4)2SO4和(NH4)2Fe(SO4)2三份溶液物质的量浓度依次增大
难度: 简单查看答案及解析
-
某密闭容器中发生如下反应:X(g)+3Y(g)
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是

A.t1时升高了温度 B.t3时加入了催化剂
C.t5~t6时刻,Y转化率最小 D.在t3~t4时间内,X的体积分数最大
难度: 简单查看答案及解析