-
随着社会的发展,人们日益重视环境问题,下列说法不正确的是( )
A.绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染
B.对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤
C.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体
D.PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.漂白粉长时间露置空气中会变质失效
B.澄清石灰水可用来鉴别Na2CO3和NaHCO3溶液
C.高温下SiO2能与Na2CO3反应放出CO2,但不能说明H2SiO3的酸性强于H2CO3
D.金属的化学腐蚀和电化学腐蚀的本质相同,但电化学腐蚀伴有电流产生
难度: 中等查看答案及解析
-
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:

则下列判断正确的是( )
A.MFe2Ox是氧化剂 B.SO2是该反应的催化剂
C.x<y D.MFe2Oy是还原产物
难度: 中等查看答案及解析
-
下列说法正确的是(其中NA表示阿伏伽德罗常数)( )
A.常温常压下,0.1mol 2H216O中含中子数、质子数、电子数均为NA
B.比黄金还贵的18O2和普通的16O2是两种不同的核素
C.标准状况下,2.24LCl2溶于水,转移的电子数目为0.1NA
D.1L2mol·L-1的Al(NO3)3溶液中含Al3+个数为2NA
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、HCO3-、NO3-
B.1.0 mol·L-1KNO3溶液:H+、Fe2+、Cl-、SO42-
C.含有0.1 mol·L-1 Ca2+溶液:Na+、K+、CO32-、Cl-
D.澄清透明的溶液:Na+、K+、MnO4-、[Al(OH)4]-
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是 ( )
A.常温下浓硫酸与铝不发生反应,可在常温下用铝制容器贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有氧化性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
难度: 中等查看答案及解析
-
以下关于物质元素组成的说法正确的是( )
A.碱都含氢元素 B.酸都含氧元素
C.盐都含金属元素 D.有机物都含碳、氢、氧元素
难度: 中等查看答案及解析
-
一定条件下氨气和氧化铜可以发生如下反应:2NH3+3CuO
3Cu+N2+3H2O,对此反应的分析合理的是( )
A.该反应属置换反应
B.CuO是氧化剂
C.反应体现了金属铜的还原性
D.每生成1molH2O就伴随着1mol电子转移
难度: 中等查看答案及解析
-
2011年3月11日,日本大地震引起全世界关注,中国核事故应急协调委员会4月1曰发布,内地除西藏外都检测到
,还检测到了极微量的人工放射性核素
、
。已知铯(Cs)是钠的同族元素,据此,下列关说法正确的是( )
A.
、
互为同位素
B.
放出射线是一个自发的化学变化过程,射线对人危害很大
C.
与
的中子数相同
D.单质铯的金属性比单质钠弱
难度: 中等查看答案及解析
-
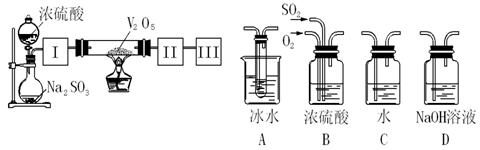
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 ( )
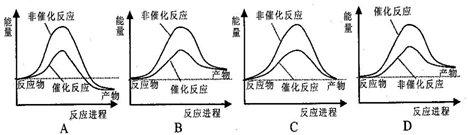
难度: 简单查看答案及解析
-
某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是 ( )
A. Na+ B.SO42- C. Ba2+ D.NH4+
难度: 中等查看答案及解析
-
用铂电极电解某溶液一段时间,该溶液浓度增大而pH减小,该溶液是 ( )
A.NaOH B.CuCl2 C.H2SO4 D.CuSO4
难度: 中等查看答案及解析
-
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态氢化物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁的最外层电子数和电子层数相等,则下列说法中正确的是 ( )
A.原子半径:丙>乙>丁
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
难度: 困难查看答案及解析
-
将一粒黄豆大小的金属钠,投入含饱和食盐水的烧杯中,下列实验现象不正确的( )
A.反应后的水溶液可以使酚酞变红
B.钠跟食盐反应比与水反应更剧烈,并放出热量,发现嘶嘶声
C.钠熔成一个闪亮的小球,并在液面上向各方向迅速游动最后消失
D.食盐水出现浑浊现象
难度: 中等查看答案及解析
-
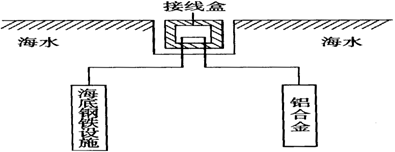
某小组为研究电化学原理,设计如下图装置。下列叙述不正确的是 ( )
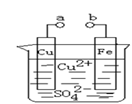
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.医用酒精的浓度通常为95%
B.单质硅是将太阳能转变为电能的常用材料
C.淀粉、纤维素和油脂都属于天然高分子化合物
D.合成纤维和光导纤维都是新型无机非金属材料
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW。该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.a = b
B.混合溶液的pH = 7
C.混合溶液中,c(H+) =
mol/L
D.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-)
难度: 中等查看答案及解析
-
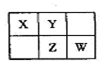
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如右图所示。下列说法正确的是( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.元素Y、W的气态氢化物的稳定性,前者比后者差
C.离子Y2-和Z3+的离子半径,后者比前者大
D.元素W的最高价氧化物对应的水化物酸性比Q的强
难度: 中等查看答案及解析
-
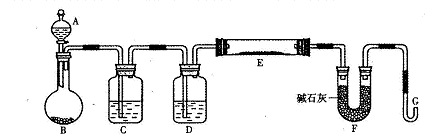
按下图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
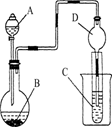
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色。
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,则C中溶液变浑浊。
C.实验仪器D主要起到洗气的作用。
D.若A为浓氨水,B为生石灰,C中AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解。
难度: 中等查看答案及解析
-
恒温、恒容的条件下对于N2(g)+3H2(g)
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为( )
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的压强不变
D.N2、H2、NH3分子数之比为1:3 :2的状态
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
操作和现象 结论
A 向NaCl溶液中先滴加少量AgNO3溶液,后滴加少量NaI溶液,先有白色沉淀,后变成黄色沉淀 说明Ksp(AgI)<Ksp (AgCl)
B 将SO2通入酸性KMnO4溶液中,紫色褪去 说明SO2具有漂白性
C 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 说明氧化性:Cu2+>Fe3+
D 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 该溶液中一定含有Ag+
难度: 中等查看答案及解析
-
在25℃时,在浓度为1 mol·L-1的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2的溶液中,测得其c(NH4+)分别为a、b、c(单位为mol·L-1)下列判断正确的是( )
A.a>b>c B.b>a>c C.c>b>a D.c>a>b
难度: 中等查看答案及解析