-
元素周期表是学习化学的重要工具。下列有关我们常用的元素周期表的说法正确的是( )
A. 元素周期表有18个纵行,共有16个族
B. 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻
C. 短周期是指第一、二、三、四周期
D. IA族的元素全部是金属元素
难度: 简单查看答案及解析
-
金属铬是硬度最大的金属。下列有关54Cr和50Cr的说法正确的是( )
A. 54Cr和50Cr的质量数不同,属于两种元素
B. 54Cr和50Cr的质子数相同,互称同位素
C. 54Cr和50Cr的质子数相同,是同一种核素
D. 54Cr和50Cr的质子数相同,中子数不同,互称同素异形体
难度: 简单查看答案及解析
-
下列有关化学用语表达正确的是( )
A. 中子数为8的N原子:87N B. C1-的结构示意图:
C. HClO的电子式:
D. 过氧化氢的电子式:
难度: 中等查看答案及解析
-
地球上氦元素主要以4He形式存在,月球上氦元素主要以3He形式存在,已知一个12C原子的质量为a g,一个3He 原子的质量为b g,一个4He 原子的质量为c g。下列说法正确的是( )
A. 3He的电子式为:
B. 3He的相对原子质量约为bNA,氦元素的相对原子质量为
C. 3He、4He为氦元素的同素异形体,同温同压下,密度之比为c∶b
D. 3He、4He为氦元素的同位素,同温同压下,等体积的质量之比为b∶c
难度: 中等查看答案及解析
-
某元素R的核内含有N个中子,R的质量数为A,在其与氢化合时,R呈-n价,则Wg R的气态氢化物中所含电子的物质的量为 ( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
W、X、Y、Z为四种短周期主族元素,在周期表中的位置如图所示。Z原子最外层电子数目是最内层电子数的3倍。下列说法正确的是 ( )
W
X
Y
Z
A. Y的最高价氧化物对应水化物能溶解在氨水中
B. Y的简单离子半径大于X的简单离子半径
C. X的简单氢化物稳定性高于Z的简单氢化物稳定性
D. W单质的燃烧产物是引发酸雨的主要原因
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期的相邻元素,下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)(n+1)也为强碱
B. 若X的最高正化合价为+5,则五种元素都是非金属元素
C. 若Y的最低化合价为−2,则Z的最高正化合价为+7
D. 若HnXOm为强酸,则Y是活泼非金属元素
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是 ( )
A. 有化学键断裂的变化一定是化学变化
B. CaCl2晶体中含有离子键和非极性键
C. 共价化合物中一定只含有共价键
D. 只含非金属元素的物质一定不含离子键
难度: 简单查看答案及解析
-
单斜硫和正交硫转化为二氧化硫的能量变化如下图所示。下列说法正确的是( )

A. 由图可知,单斜硫转化为正交硫的反应为吸热反应
B. 正交硫比单斜硫性质活泼
C. 相同条件下,等量的正交硫比单斜硫所含有的能量低
D. 相同条件下,生成等量的二氧化硫气体,正交硫放出的热量多
难度: 中等查看答案及解析
-
下列物质中不含非极性共价键的化合物是:①Na2O2 ② N2 ③CCl4④ H2O2 ⑤ NH4Cl ⑥NaOH( )
A. ③⑤⑥ B. ②④⑤⑥ C. ②④⑥ D. ②③⑤⑥
难度: 简单查看答案及解析
-
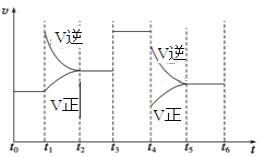
对于放热反应COCl2(g)
CO(g) + Cl2(g)。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A. ①②④ B. ④⑥ C. ②③⑤ D. ③⑤⑥
难度: 中等查看答案及解析
-
二氧化硫的催化氧化原理为2SO2(g)+O2(g)
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是 ( )
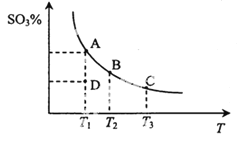
A. 在D点时v 正<v逆
B. 反应2SO2(g)+O2(g)
2SO3(g)为放热反应
C. 若B、C点的反应速率分别为vB、vC,则vB<vC
D. 恒温恒压下向平衡体系中通入氦气,平衡向左移动
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法中,正确的是( )
A. 100mL2mol/L的盐酸与锌反应时,加入适量的硫酸钠溶液,生成氢气的速率不变
B. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C. 密闭容器中反应:N2(g)+3H2(g)
2NH3(g),当温度、压强不变,充入惰性气体,反应速率减慢
D. 用铁片和稀硫酸反应制取氢气时,增大压强,反应速率加快
难度: 中等查看答案及解析
-
图中装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于 ( )
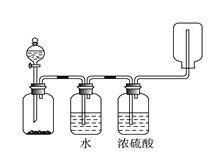
A. 锌和盐酸生成氢气
B. 二氧化锰和浓盐酸生成氯气
C. 碳酸钙和盐酸生成二氧化碳
D. 浓氨水和烧碱制取氨气
难度: 中等查看答案及解析
-
下列装置或操作能达到实验目的的是( )
A. 除去氯气中的氯化氢
 B. 盛放浓硫酸
B. 盛放浓硫酸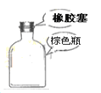
C. 实验室制取氨气
 D. 利用排空气法收集二氧化碳
D. 利用排空气法收集二氧化碳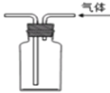
难度: 中等查看答案及解析
-
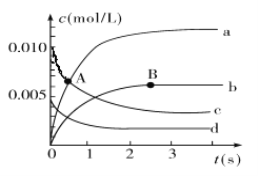
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置
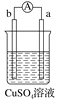
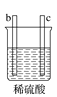
部分实验现象
a极质量减小b极质量增加
b极有气泡产生c极无变化
实验装置
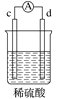
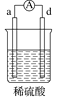
部分实验现象
d极溶解c极有气泡产生
电流从a极流向d极
由此判断这四种金属的活动性顺序是( )
A. a>b>c>d B. d>a>b>c C. b>c>d>a D. a>b>d>c
难度: 中等查看答案及解析
-
LED(Light Emitting Diode)即发光二极管,是一种能够将电能转化为光能的固态半导体器件。如图是某课外活动小组设计的用化学电源使LED灯发光的装置。下列说法不正确的是( )

A. 溶液中SO42-向铜片附近移动
B. 铜片上发生的反应为2H++2e-=H2↑
C. 导线中电子由锌片流向铜片
D. 如果将锌片换成铁片,则电路中的电流方向不变
难度: 中等查看答案及解析
-
氢氧燃料电池已用于航天飞机,它是以铂作电极,H2SO4溶液作电解质溶液,正极反应为O2+4H++4e-===2H2O。下列叙述正确的是 ( )
A. 燃料电池的能量转化率可达100% B. 电池工作时H+移向负极
C. 电池工作时产生淡蓝色火焰 D. 负极反应为H2-2e-===2H+
难度: 中等查看答案及解析