-
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②太阳能 ③风能 ④石油 ⑤煤 ⑥生物质能 ⑦氢能
A. ①②③④ B. ②③⑥⑦ C. ①②⑤⑥⑦ D. ③④⑤⑥⑦
难度: 简单查看答案及解析
-
简单原子的原子结构可用下图形象地表示:
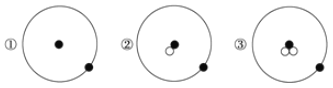
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是
a.①②③互为同位素 b.①②③互为同素异形体 c.①②③具有相同的质量数
d.①②③是三种化学性质不同的粒子 e.①②③具有相同的质量 f.①②③是三种不同的原子
A. e、f B. b、c C. d、e D. a、f
难度: 简单查看答案及解析
-
“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
A. 活化分子之间的碰撞不一定都是有效碰撞
B. 升高温度,可使单位体积内活化分子增多,反应速率加快
C. 对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快
D. 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加
难度: 中等查看答案及解析
-
对于反应A +B=C,下列条件的改变一定使化学反应加快的是
A. 增加A的物质的量 B. 升高体系的温度
C. 减少C的物质的量 D. 增加体系的压强
难度: 中等查看答案及解析
-
下列各分子中所有原子都满足最外层为8电子结构的是
A. BF3 B. H2S C. CCl4 D. PCl5
难度: 中等查看答案及解析
-
下列反应既属于氧化还原反应,又属于吸热反应的是
A. 生石灰变成熟石灰的反应 B. Ba(OH)2·8H2O和NH4Cl的反应
C. 灼热的炭与CO2的反应 D. 铝片与稀盐酸的反应
难度: 简单查看答案及解析
-
在2A(g)+3B(g)
2C(g)+D(g)中,下列表示反应速率最快的是
A. v(A)=0.5 mol/(L·min) B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min) D. v(D)=0.3 mol/(L·min)
难度: 简单查看答案及解析
-
下列物质中既含离子键又含有非极性共价键的是
A. MgCl2 B. NH4Cl C. H2O2 D. Na2O2
难度: 简单查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ· mol-1,则氢气的燃烧热为241.8kJ·mol-1
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则石墨比金刚石稳定
C. 已知NaOH(ag)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.4kJ·mol-1,则含20.0gNaOH的稀溶液与浓硫酸完全中和,放出28.7kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) △H1和2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于SO2和O2合成SO3
C. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
已知A、B分别为同周期的ⅠA族和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是
A. n=m+16 B. n=m+6 C. n=m+30 D. n=m+10
难度: 中等查看答案及解析
-
强酸和强碱稀溶液的中和热可表示为:
H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ/mol
已知:①HCl(aq)+NH3·H2O(aq) =NH4Cl(aq)+H2O(l) ΔH =-a kJ/mol
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH=-bkJ/mol
③Ba(OH)2(aq)+H2SO4(aq) = BaSO4(s)+2H2O(l) ΔH=-ckJ/mol
则a、b、c三者的大小关系判断错误的是
A. 2a=2b=c B. a<57.3 C. b>57.3 D. c>114.6
难度: 中等查看答案及解析
-
在一密闭容器中,反应aA(气)
bB(气)达到平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则下列说法正确的是
A. a>b B. 物质A的转化率减少了
C. 平衡向逆反应方向移动了 D. 物质B的质量分数增加了
难度: 中等查看答案及解析
-
已知:C2H2(g)+5/2 O2(g) = 2CO2(g)+H2O(g) ΔH=-1256 kJ/mol,下列说法正确的是
A. 乙炔(C2H2)的燃烧热为1256kJ/mol
B. 若该反应转移10NA电子时,则放出的热量为2512kJ
C. 乙炔燃烧生成2 mol液态水时,则放出的热量为2512kJ
D. 若该反应形成4 mol碳氧共用电子对时,则放出的热量为628kJ
难度: 中等查看答案及解析
-
下图为元素周期表中短周期的一部分,四种元素均为非稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是

A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:W<Z<X<Y
C. Z的最高价氧化物的水化物可能为强碱
D. W的最高正化合价与负化合价的绝对值可能相等
难度: 中等查看答案及解析
-
已知碳有两种常见的同位素12C、13C;氧也有常见的三种同位素16O、17O、18O,由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有
A. 6种 B. 10种 C. 11种 D. 12种
难度: 中等查看答案及解析
-
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2molSO2、1molO2充入一密闭容器充分反应后,放出热量98.3kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A. 2SO2(g)+O2(g)
2SO3(g) ΔH=-196.6 kJ/mol
B. 2SO2(g)+O2(g)
2SO3(g) ΔH=-98.3 kJ/mol
C. SO2(g)+
O2(g)
SO3(g) ΔH=+98.3 kJ/mol
D. SO2(g)+
O2(g)
SO3(g) ΔH=-196.6 kJ/mol
难度: 中等查看答案及解析
-
在体积相同的甲、乙两个容器中,分别充有2 mol SO2和1mol O2,在相同的温度下发生反应2SO2+O2
2SO3,并达到平衡,在该过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
难度: 中等查看答案及解析
-
在25℃、1.01×105 Pa下,将22gCO2通入750mL1mol/L NaOH 溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1 molCO2通入1L2mol/LNaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是
A. CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ/mol
B. CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ/mol
C. CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4y-x)kJ/mol
D. CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ/mol
难度: 中等查看答案及解析
-
如下图表示反应2SO2(g)+O2(g)
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是

A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
难度: 中等查看答案及解析
-
在容积固定的密闭容器中存在反应:A(g)+3B(g)
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:

下列判断正确的是
A. 图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B. 图Ⅱ研究的是温度对反应的影响,且甲的温度较高
C. 图Ⅱ研究的是压强对反应的影响,且甲的压强较大
D. 图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
难度: 中等查看答案及解析
-
某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在a g 2HmX中所含电子的物质的量是
A.
(A-N+m) mol B.
(A-N) mol
C.
(A-N+m) mol D.
(A-N+2m) mol
难度: 中等查看答案及解析
-
一定温度下,反应2SO2+O2
2SO3,达到平衡时n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是
A. 0.4mol B. 0.6mol C. 0.8mol D. 1.2mol
难度: 中等查看答案及解析
-
已知下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.5 kJ·mol-1
②2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) ΔH=-3199.6 kJ·mol-1
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411 kJ·mol-1
④2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1
⑤C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2219.9 kJ·mol-1
现有2 mol由上述五种物质中的两种组成的气体混合物,经充分燃烧后放出2970.8kJ热量,则下列哪些组合是可能的
A. CH4和C2H2 B. C2H4和C3H8 C. C2H6和C3H8 D. C2H4和C2H2
难度: 中等查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);②2HI(g)
H2(g)+I2(g)。
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=3mol·L-1,则此温度下反应①的平衡常数为
A. 9 mol2·L-2 B. 12 mol2·L-2 C. 16 mol2·L-2 D. 20 mol2·L-2
难度: 困难查看答案及解析