-
“绿水青山就是金山银山”。下列做法有利于环境保护和可持续发展的是
A. 生活垃圾直接露天焚烧,减少处理成本
B. 大量生产一次性超薄塑料袋,方便日常生活
C. 加大农药和化肥的生产和使用量,以提高粮食的产量
D. 推行绿色设计、绿色工艺,开发绿色产品,从源头上消除污染
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素,Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和比为5:4。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y) > r(X)
B. Y 的简单气态氢化物的热稳定性比Z的强
C. 由X、Z 组成的化合物与由Z、W组成的化合物只能发生化合反应
D. 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
难度: 困难查看答案及解析
-
下列有关化学用语的表示正确的是
A. 中子数为20的氯原子:
B. 过氧化氢的电子式:
C. S2-的结构示意图:
D. CO2分子的球棍模型:
难度: 中等查看答案及解析
-
下列各组微粒中,属于同位素的是
A.
和
B. H2O和D2O
C. O2与O3 D. CH3CH2OH与CH3OCH3
难度: 简单查看答案及解析
-
下列物质中,含共价键的离子化合物是
A. CaCl2 B. HCl C. CO2 D. Na2O2
难度: 中等查看答案及解析
-
下列装置能达到相应实验目的的是
A. 证明铁生锈有空气参与

B. 制取氨气

C. 分离碘和酒精

D. 收集少量二氧化氮气体

难度: 中等查看答案及解析
-
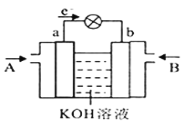
锂海水电池常用在海上浮标等助航设备中,其示意图如图所示。电池反应为2Li+2H2O===2LiOH+H2↑。电池工作时,下列说法错误的是( )

A. 金属锂作负极
B. 电子从锂电极经导线流向镍电极
C. 海水作为电解质溶液
D. 可将电能转化为化学能
难度: 简单查看答案及解析
-
实验室用铁片和稀硫酸反应制备H2。下列说法不正确的是
A. 升高温度能加快反应速率
B. 用铁粉代替铁片能加快反应速率
C. 滴入数滴CuSO4溶液能加快反应速率
D. 增加稀硫酸用量能加快反应速率
难度: 中等查看答案及解析
-
下列反应中,属于氧化还原反应且反应前后能量变化如下图所示的是
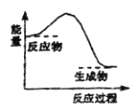
A. 生石灰溶于水
B. 高温条件下铝与氧化铁的反应
C. 高温条件下碳粉与二氧化碳的反应
D. Ba(OH)2·8H2O晶体与NH4Cl固体的反应
难度: 中等查看答案及解析
-
X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现图所示转化关系的是
X
Y
Z
箭头上所标数字的反应条件
A.
NO
NO2
HNO3
① 常温遇氧气
B.
Cl2
NaClO
HClO
② 通入CO2
C.
Fe
FeCl2
FeCl3
③ 加入Cu
D.
Al2O3
NaAlO2
Al(OH)3
④ 加NaOH溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
无色的混合气体甲中可能含有NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过下图实验处理,结果得到酸性溶液,还有少量气体剩余,则气体甲的组成可能为

A. NH3、NO、N2 B. NH3、NO、CO2
C. NH3、NO2、CO2 D. NO、CO2、N2
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 石灰石溶于盐酸:CO32ˉ+2H+ = CO2↑+H2O
B. 少量二氧化硫与氨水反应:SO2+NH3·H2O = NH4++HSO3ˉ
C. Na与CuSO4水溶液反应:2Na+Cu2+ =Cu +2Na+
D. 铜溶于浓硝酸中:Cu+4H++2NO3ˉ═Cu2++2NO2↑+2H2O
难度: 中等查看答案及解析
-
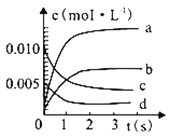
一定温度下,将 2 molSO2 和 1 molO2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+O2(g)
2SO3(g);△H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A. 生成 SO3为2 mol
B. 反应放出 197 kJ 的热量
C. SO2和SO3 物质的量之和一定为 2mol
D. SO2、O2、SO3的物质的量之比一定为2:1:2
难度: 中等查看答案及解析
-
下列有关物质的性质与其用途相对应的是
A. SiO2硬度大,可用于制光导纤维
B. N2性质稳定,工业生产金属镁时,为防止其氧化,可以用N2作保护气
C. 液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂
D. KAl(SO4)2·12H2O易溶于水,可用作净水剂
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
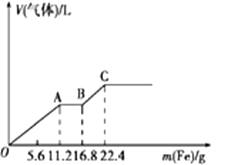
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
难度: 困难查看答案及解析
 、
、  ③金刚石、C60 ④
③金刚石、C60 ④