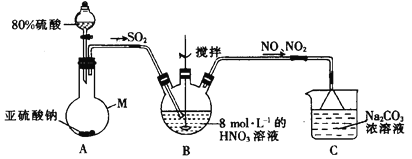
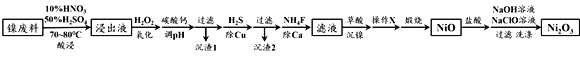
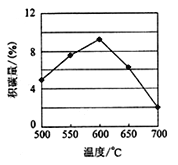
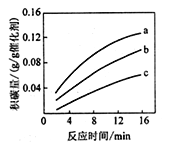
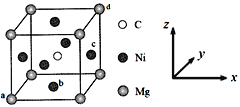
-
四种短周期主族元素X、Y、Z和W,原子序数依次增大,X和Y的单质化合生成气体A,A分子中的电子数与氖原子相同,X和W的单质化合生成气体B,常温下0.1mol/L的B溶液的pH=1,气体A和气体B相遇产生白烟,X与Z可按原子个数比1︰1形成化合物C。下列说法正确的是( )
A. 化合物C可能为离子化合物
B. Z离子的半径比Y离子的大
C. Y的非金属性很强,其单质非常活泼
D. 最高价氧化物的水化物的酸性Y比W强
难度: 中等查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关。下列说法不正确的是( )
A. 成分为盐酸的洁厕灵与84消毒液混合使用易中毒
B. 利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异来检验是否酒后驾车
C. 水泥冶金厂常用高压电除尘,是因为烟尘在空气中形成胶体且发生丁达尔效应
D. PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是产生雾霾天气的主要因素
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1 NA
B. 标准状况下,2.24LH2O中含有的共价键数目为0.2NA
C. 6.2 g白磷分子中含P—P键为0.2 NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3 NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. BaSO3与稀HNO3反应:BaSO3+2H+=Ba2++SO2↑+H2O
B. 用纯碱溶液溶解苯酚:CO32-+2C6H5OH=2C6H5O-+CO2↑+H2O
C. 等体积等物质的量浓度的NH4Fe(SO4)2和Ba(OH)2混合:2Fe3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Fe(OH)3↓
D. 用石墨作电极电解MgCl2溶液:2Cl-+2H2O
Cl2↑+H2↑+2OH-
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向硅酸钠溶液中滴加盐酸,有白色胶状沉淀生成
非金属性:C1>Si
B
某溶液中加入硝酸酸化的Ba(NO3)2溶液,无现象,再滴加AgNO3溶液,有白色沉淀生成
溶液中一定含有Cl-
C
淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸,无红色沉淀生成
淀粉没有水解
D
向FeCl2溶液中加入足量Na2O2粉末,出现红褐色沉淀和无色气体
FeCl2溶液部分变质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
元素周期表中钌(Ru)与铁相邻位于铁的下一周期,某钌光敏太阳能电池的工作原理如下图所示,图中RuII*表示激发态。下列说法正确的是( )

A. 电池工作时,直接将太阳能转化为电能
B. 镀铂导电玻璃的作用是传递I-
C. 电池的电解质溶液中I- 和I3-的浓度不断减小
D. 电解质溶液中发生反应:2Ru3+ + 3I-= 2Ru2+ + I3-
难度: 中等查看答案及解析
-
化学上常用AG表示溶液中的酸碱度,AG=lg
。25℃时,用0.100 mol·L-1的NaOH溶液滴定20.0 mL 0.100 mol·L-1某酸(HA)溶液,AG与所加NaOH溶液的体积(V)关系如图所示,下列说法正确的是

A. B点溶液中存在2c(H+)-2c(OH-)=c(A-)-c(HA)
B. C点时,加入NaOH溶液的体积大于20.00 mL
C. 滴定过程中应该选择甲基橙做指示剂
D. 25℃时,该酸HA的电离平衡常数Ka=1.0×10-5.5
难度: 困难查看答案及解析