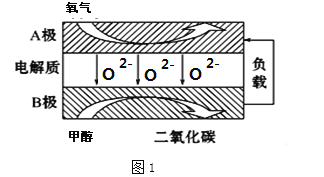
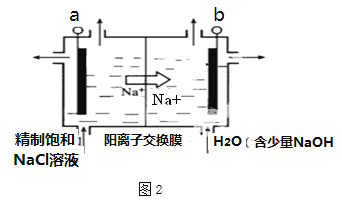
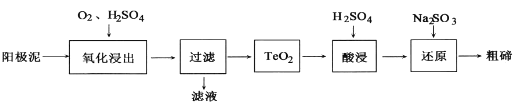
-
下列能级符号书写错误的是
A. 4f B. 2d C. 5s D. 3p
难度: 中等查看答案及解析
-
电化学知识在日常社会生产、生活中应用非常广泛。下列有关电化学知识说法正确的是
A. 纯银手镯佩戴过程总变黑是因为发生了电化学腐蚀
B. 充电电池在充电过程中可以将电能全部转化为化学能存储起来
C. 铸铁锅长时间存留盐液时出现锈斑是因为发生了析氧腐蚀
D. 镀铜眼镜框长时间受汗水等侵蚀产生铜锈是因为金属铜发生了吸氧腐蚀
难度: 中等查看答案及解析
-
设NA表示阿伏伽德罗常数,下列说法正确的是
A. 1molCS2分子中含有1NA个π键
B. 31g白磷(P4)分子中所含的共价键数目为1NA
C. 电解精炼铜时,若阳极质量减少64g,则阴极转移的电子数目一定为2NA
D. 在1mol[Cu(H2O)4]2+中含有12NA个
键
难度: 中等查看答案及解析
-
原子序数在前36号的某原子最外层电子排布式为ns1,则该原子在元素周期表中不可能位于
A. IA族 B. VIB族 C. VIII族 D. IB族
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 每个能层s能级的原子轨道的形状相同,能层序数越大,轨道半径越大,电子能量越高
B. 原子核外电子云是核外电子运动后留下的痕迹
C. 教材中说“核外电子的概率密度分布看起来像一片云雾,因为被形象地称作电子云”,这说明原子核外电子云是实际存在的
D. 每个能层都有P能级,P能级都有3个原子轨道
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. CO2的分子模型示意图:
 B. 次氯酸的电子式:
B. 次氯酸的电子式:
C. P4的路易斯结构式:
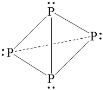 D. 激发态氮原子:1s22s2px12py12pz1
D. 激发态氮原子:1s22s2px12py12pz1难度: 中等查看答案及解析
-
下列微粒的价层电子对互斥模型(VSEPR模型)和微粒的空间构型不相同的是
A. PCl3 B. BCl3 C. CO32- D. NO3-
难度: 中等查看答案及解析
-
下列微粒的中心原子的杂化类型不相同的是
A. C6H6(苯) C2H4 B. SO3 SO32-
C. C2H2 HCN D. H3O+ NH4+
难度: 中等查看答案及解析
-
下列各项叙述错误的是
A. 如果硫原子核外电子排布图为
 ,则违反了泡利原理
,则违反了泡利原理B. 如果25号Mn元素的基态电子排布式为1s22s22p63s23p63d7,则违反了构造原理
C. 氮原子的核外电子排布图为
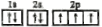 ,符合洪特规则和泡利原理
,符合洪特规则和泡利原理D. 泡利原理、洪特规则、构造原理都是对核外电子排布满足能量最低的要求
难度: 中等查看答案及解析
-
推理是学习化学知识的一种重要方法。下列推理合理的是
A. SO2中硫原子采取sp2杂化,则CO2中碳原子也采取sp2杂化
B. NH3分子构型是三角锥形,则NCl3分子构型也是三角锥形
C. H2O分子的键角是104.5°,则H2S分子的键角也是104.5°
D. PCl3分子中每个原子达到8电子稳定结构,则BF3分子中每个原子也能达到8电子稳定结构
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表,下列叙述正确的是
元素代号
X
Y
Z
W
原子半径/pm
160
143
70
66
主要化合价
+2
+3
+5、+3、-3
-2
A. Z的气态氢化物的稳定性强于W的气态氢化物的稳定性
B. ZH3的键角大于H2W的键角,是因为Z——H的键长比W——H的键长长
C. 化合物X3Z2中存在离子键和非极性共价键
D. YCl3是共价化合物,Y2W3是离子化合物
难度: 中等查看答案及解析
-
下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
难度: 中等查看答案及解析
-
如表所示的五种元素中, A. B. C. D为短周期元素,这四种元素的原子最外层电子数之和为22,下列说法正确的是
B
C
A
D
E
A. 应用高纯度单质A制成光导纤维,可提供信息传输速度
B. B、C、D三种元素的简单氢化物的沸点依次升高
C. 由B、C和氢三种元素形成的化合物中可能含有离子键
D. E在元素周期表中的位置是第4周期IVA族,简化电子排布式为[Ar]4s24p2
难度: 中等查看答案及解析
-
已知X和Y均为第三周期元素,其原子的第一至第四电离如下表所示:下列说法正确的是
电离能/kJ·mol-1
I1
I2
I3
I4
X
578
1817
2745
11578
Y
738
1451
7733
10540
A. X通常显+3价,Y通常显+1价
B. X的第一电离能力大于Y的第一电离能
C. X、Y的最高价氧化物的水化物都不能与氢氧化钠反应
D. 工业上制取X采用的是电解熔融的X的氧化物,制取Y采取的是电解熔融的Y的氯化物
难度: 中等查看答案及解析
-
在盛有稀硫酸的烧杯中放入用导线连接的铁片与碳棒,下列叙述正确的是
A. 正极附近的SO42-离子浓度逐渐增大
B. 碳棒上有H2逸出
C. 正极有O2逸出
D. 电子通过导线由碳棒流向铁片
难度: 中等查看答案及解析
-
铅蓄电池是典型的可充型电池,起反应为Pb+PbO2+4H++2SO42-
2PbSO4+2H2O:,下列说法正确的是
A. 放电时负极质量减少,正极质量增加,电解质溶液中H2SO4的浓度将变小
B. 放电时负极的电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
C. 充电时Pb与电源正极相连
D. 充电时阳极上pbSO4变为PbO2,发生氧化反应
难度: 中等查看答案及解析
-
下列有关装置图的叙述正确的是
A.
 装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+
装置①中的总反应为:Cu+2Fe3+=Cu2++2Fe2+B.
 装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大
装置②中的开关由M改置于N时,Cu-Zn合金的腐蚀速度增大C.
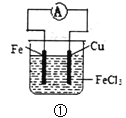
 装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法
装置③中在Fe电极区无蓝色沉淀,该方法叫牺牲阳极的阴极保护法D.
 装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀
装置④中桥墩与外加电源正极连接能确保桥墩不被腐蚀难度: 中等查看答案及解析
-
当电池工作时,下列说法错误的

A. 甲池中N极的电极反应式为:O2+4e-+4H+=2H2O
B. 当N极消耗5.6L(标准状况下)O2时,铁极增重32g
C. 电子的流动方向为M→Fe→CuSO4溶液→Cu→N
D. M极上发生的是氧化反应
难度: 中等查看答案及解析
-
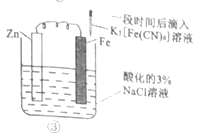
某同学组装了如图所示的电化学装置,电极I为Al,其他电极均为Cu,下列说法正确的是

A. 盐桥中通常装有含琼脂的KCl饱和溶液,起作用是平衡电荷,电池工作时,K+、Cl-会分别进入两边的溶液中
B. 该装置工作一段时间后,电极III上有红色固体析出
C. 该装置工作一段时间后,③号烧杯中电解质溶液浓度不变,两个电极的质量不变
D. 该装置工作时,③号烧杯中的SO42-向电极IV移动
难度: 中等查看答案及解析
-
近年来AIST报告正在研制一种“高容量、低成本”的锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是
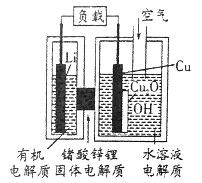
A. 正极为Li,负极为Cu
B. 放电时,正极的电极反应为:2Cu+2OH-+2e-==Cu2O+2H2O
C. Li极有机电解质可以换成Cu极的水溶液电解质
D. 通空气时,整个反应过程中,铜相当于催化剂
难度: 中等查看答案及解析
-
工业上可以通过电解NO2制备NH4NO3,其工作原理如图所示,下列说法正确的是

A. 电解过程中,阴极区NO2流入速率比阳极区NO2流入速率快些
B. 阴极区消耗1molNO2需补充6mol化合物X
C. 阳极反应为:NO2+e-+H2O=NO3-+2H+
D. 电解过程中,阴极区的pH小于阳极区的pH
难度: 中等查看答案及解析
-
用惰性电极电极500mlKCl和Cu(NO3)2组成的混合溶液,一段时间后两极都得到22.4L(标准状况下)气体,电解后将溶液混合均匀后呈中性,则此溶液中NO3-的物质的浓度为
A. 2mol·L-1 B. 1.2mol·L-1 C. 4mol·L-1 D. 1mol·L-1 .
难度: 中等查看答案及解析