-
在无色强酸性溶液中,下列各组离子能够大量共存的是
A. Na+、Ba2+、NO3-、SO42- B. NH4+、HCO3-、Cl-、K+
C. Cl -、K+、NO3-、NH4+ D. Al3+、Cu2+、Cl-、SO42-
难度: 简单查看答案及解析
-
化学与生产、生活、科技等密切相关。下列说法正确的是
A. “华为P30 pro”手机中麒麟芯片的主要成分是二氧化硅
B. “试玉要烧三日满,辨材须待七年期”,该诗句表明玉的硬度很大
C. 海水中加入明矾可以使海水淡化
D. Al(OH)3具有弱碱性,可用于制作胃酸中和剂
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. SO2具有氧化性,可用于漂白纸浆
B. Al2O3 熔点高,可用作耐高温材料
C. Fe2(SO4)3 易溶于水,可用作净水剂
D. NH4HCO3 受热易分解,可用作氮肥
难度: 中等查看答案及解析
-
已知:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O反应,下列说法正确的是( )
A. 每消耗1molMnO2生成Cl2的体积为22.4L
B. 氧化剂与还原剂的物质的量之比为1:4
C. 氧化性:MnO2>Cl2
D. 反应中每生成1molCl2时,转移电子的物质的量为4mol
难度: 中等查看答案及解析
-
NA 代表阿伏加德罗常数的值,下列有关叙述不正确的是
A. 56g 铁在1mol 氯气中充分反应后转移电子数为 3NA
B. 标准状况下6.72LNO2 与水充分反应转移的电子数目为0.2NA
C. 14g 由 N2 与 CO 组成的混合气体含有的原子数目为 NA
D. 含有 NA 个 Fe( OH)3 胶粒的氢氧化铁胶体中,铁元素的质量大于 56g
难度: 中等查看答案及解析
-
向下列溶液中加入相应试剂后,发生反应的离子方程式正确的是
A. 向 CuSO4 溶液中加入 Ba(OH)2 溶液:SO42-+Ba2+=BaSO4↓
B. 向 AlCl3 液中加入过量氨水 Al3++3NH3•H2O=Al(OH)3↓+3NH4+
C. 铁粉加入稀硫酸中 2Fe+6H+=2Fe3++3H2↑
D. 向FeI2溶液中加入足量新制氯水 Cl2+2I-=2C1-+I2
难度: 中等查看答案及解析
-
下列有关实验的说法正确的是
A. 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,该溶液一定有 CO32﹣
B. 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量
C. 制备 Fe(OH)3 胶体,通常是将 Fe(OH)3 固体溶于热水中
D. 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤
难度: 中等查看答案及解析
-
下列有关浓硫酸的叙述正确的是
A. 浓硫酸能使胆矾晶体变色,体现了吸水性
B. 浓硫酸与金属反应只会生成 SO2 气体
C. 浓硫酸不可以干燥 NH3、SO2 等还原性气体
D. 浓硫酸与 FeS 反应可以制取 H2S 气体
难度: 中等查看答案及解析
-
中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于
Lv 的叙述错误的是
A. 原子序数 116 B. 中子数 177
C. 核外电子数 116 D. 核电荷数 293
难度: 简单查看答案及解析
-
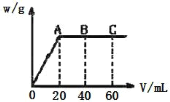
某元素的一种同位素X,其质量数为A,含质子数为Z,它与 1H原子组成HmX 分子,在agHmX中所含中子的物质的量是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
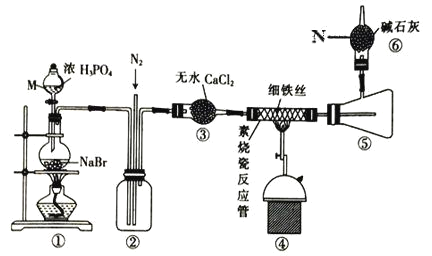
下列实验装置正确的是
A. 制取并检验二氧化硫
 B. 制取氧气
B. 制取氧气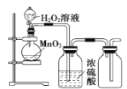
C. 制取氨气
 D. 实验室制氯气
D. 实验室制氯气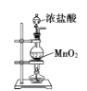
难度: 中等查看答案及解析
-
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2

C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性
D. 充分反应后,锥形瓶内有 NO3-存在
难度: 中等查看答案及解析
-
下列物质反应后,最终可以不含+3 价铁的是
①过量 Fe 与 Cl2 反应;②Fe 与过量稀硫酸反应;③FeI2 溶液中通入一定量的 Cl2;④Fe和 Fe2O3 的混合物溶于盐酸中
A. ①②④ B. ②③ C. ②③④ D. 全部
难度: 中等查看答案及解析
-
铜粉放入稀硫酸中,加热后无现象,当加入一种盐后,铜粉质量减少,溶液变蓝,同时有气体产生。此盐应是
A. KCl B. KNO3 C. FeCl3 D. K2CO3
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论不合理的是
选项
实验操作
实验现象
结论
A.
Cu片与足量浓硫酸加热反应,冷却后,再将反应混合物缓慢加入盛有冷水的烧杯中
溶液变蓝
证明反应生成了Cu2+
B.
向添加KIO3的食盐中加入淀粉溶液、稀硫酸、KI 溶液
溶液变蓝
氧化性:IO3->I2
C.
将硫酸酸化的H2O2 滴入 Fe(NO3)2 溶液
溶液变黄色
H2O2 的氧化性比Fe3+ 强
D.
将某气体通入品红溶液
溶液褪色
气体可能是 Cl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
碘在海水中主要以 I-的形式存在,在地壳中和生活中主要以 NaIO3 的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 由图可知氧化性的强弱顺序为 Cl2>I2>IO3-
B. 足量Cl2 能使湿润的KI 淀粉试纸变白的原因可能是:5Cl2+I2+6H2O===2HIO3+10HCl
C. 途径Ⅱ中若生成 1mol I2,反应中转移的电子数为 10NA
D. 可用 KI 淀粉试纸和食醋检验加碘盐中是否含有碘
难度: 中等查看答案及解析
-
在标准状况下,将 N2、O2 和 NO2 按 5∶1∶4 体积比充满干燥烧瓶,把烧瓶倒置于水中,瓶内液体逐渐上升,假设烧瓶内溶质不扩散,最终烧瓶内溶液里溶质的物质的量浓度为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
11.9g 镁、铝、铁合金投入 200 mL HNO3 溶液中,反应恰好完全,分别转化成Mg2+、Al3+和 Fe3+,还原产物为1:1的 NO2 和 NO。在反应后的溶液中加入 200 mL 某浓度的 NaOH 溶液,金属阳离子恰好全部沉淀,干燥后测得质量为 25.5 g。下列有关推断正确的是
A. 气体产物在标准状况下体积为 6.72 L
B. HNO3 的物质的量浓度为 6 mol·L-1
C. NaOH 的物质的量浓度为 6 mol·L-1
D. 参加反应的 HNO3 的物质的量为 0.8 mol
难度: 中等查看答案及解析