-
科学家预测,月球的土壤中吸附着数百万吨
,100吨
核聚变释放的能量相当于目前人类一年消耗的能量。下列说法正确的是( )
A.
的最外层的最外层电子数为2,具有较强的金属性
B.
位于周期表第一周期第ⅡA族
C. 每个氦分子中含有的质子数为2、中子数为1
D. 该原子核中质子数为2、中子数为3
难度: 简单查看答案及解析
-
据报道,在火星和金星大气层中发现了一种非常特殊的会导致温室效应的气态化合物,它的结构式为:16O=C=18O。下列说法正确的是( )
A. 1.12L16O=C=18O与1.12L16O=C=16O均含有0.1NA个氧原子
B. 16O=C=18O与16O=C=16O互为同位素
C. 质量相同的16O=C=18O和16O=C=16O 含有相同的中子数
D. 16O=C=18O和16O=C=16O在相同条件下密度比为23:22
难度: 中等查看答案及解析
-
下列化学用语中,正确的是( )
A. 镁原子的结构示意图为
B. Na2O2的电子式为

C. 生石灰的分子式为CaO
D. 1H218O摩尔质量为20
难度: 中等查看答案及解析
-
下列物质中只含有共价键的是
A. NaCl、HCl、H2O、NaOH B. Cl2、H2S、NH4Cl、SO2
C. HBr、CO2、H2O、AlCl3 D. K2O2、H2O2、H2O、O3
难度: 中等查看答案及解析
-
下列每组物质发生转化所克服的粒子间的相互作用属于同种类型的是( )
A. 碘和干冰升华 B. 氯化钠的熔化与冰的融化
C. 氯化氢和酒精溶于水 D. CO2气体通入澄清石灰水
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 某主族元素原子最外层只有1个电子,它跟卤素只可能形成离子键
B. 含有金属元素的化合物可能是共价化合物
C. 旧的化学键被破坏的反应一定是化学变化
D. 能电离出离子的化合物都是离子化合物
难度: 中等查看答案及解析
-
若把周期表原先的主、副族号取消,由左到右按原顺序编为18列。如碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )
A. 计算机芯片的组成元素位于第14列
B. 第10列元素全部是金属元素
C. 第18列元素单质全部是气体
D. 只有第2列元素的原子最外层有2个电子
难度: 中等查看答案及解析
-
0.05mol某金属单质与足量的盐酸反应,放出1.12 L H2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是( )
A. 第三周期第IA族 B. 第四周期第IA族
C. 第三周期第ⅡA族 D. 第四周期第ⅡA族
难度: 简单查看答案及解析
-
“类推”是常用的学习方法,但有时会产生错误结论。下列类推的结论中,正确的是( )
A. ⅣA族元素氢化物沸点顺序是GeH4 >SiH4 >CH4;则ⅤA族元素氢化物沸点顺序也是AsH3 >PH3 >NH3
B. 第二周期元素氢化物稳定性顺序是HF >H2O >NH3;则第三周期元素氢化物稳定性顺序也是HCl >H2S >PH3
C. 非金属元素均具有较强的氧化性,故非金属元素组成的化合物中只含共价键
D. 铊(Tl)是铝的同族元素,原子核外有6个电子层,推测Tl(OH)3是两性氢氧化物
难度: 中等查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
①若R(OH)n为强碱,则W(OH)n+1也为强碱
②若HnXOm为强酸,则Y是活泼非金属元素
③若Y的最低化合价为-2,则Z的最高正化合价可能为+7
④若X的最高正化合价为+5,则五种元素都是非金属元素
⑤若Z的氧化物对应的水化物为HZO3,则Z的最外层电子数可能不为5
A. ②③⑤ B. ①②③ C. ②③ D. ②③④
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,A、B同周期,其原子核外有三个电子层,A、C的最低价阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是( )
A. A元素的最高正价不可能是+6价 B. 原子半径:B>A>C
C. 离子半径:B2+>C->A2- D. 氧化性:C<A
难度: 中等查看答案及解析
-
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W
X
Y
Z
A. Z元素单质在化学反应中只表现氧化性
B. Z元素氧化物对应水化物的酸性一定强于Y
C. X元素形成的单核阴离子还原性大于Y
D. X、Y、Z中最简单氢化物稳定性最弱的是Y
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及某些化合价见下表。分析判断下列说法正确的是( )
元素代号
A
B
D
E
G
H
I
J
化合价
–1
–2
+4、–4
–1
+5、–3
+3
+2
+1
原子半径/nm
0.071
0.074
0.077
0.099
0.110
0.143
0.160
0.186
A. A的单质能将E单质从HE的溶液中置换出来
B. A、H、J的离子半径由大到小顺序是A>J>H
C. G元素的单质不存在同素异形体
D. E2只含有共价键,是共价化合物
难度: 中等查看答案及解析
-
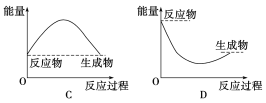
下列既属于吸热反应,又属于氧化还原反应的是( )
A. 钠与冷水反应 B. Ba(OH)2·8H2O与NH4Cl的反应
C. 灼热的炭与CO2的反应 D. 铝与氧化铁的反应
难度: 中等查看答案及解析
-
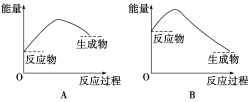
化学反应A2 + B2 = 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
难度: 中等查看答案及解析
-
生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键
键能
941.7
154.8
283.0
下列说法中正确的是( )
A. 反应中
 为吸热反应
为吸热反应B. 过程
 放出能量
放出能量C. 反应中
 ,N2与F2的总能量小于NF3的总能量
,N2与F2的总能量小于NF3的总能量D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
难度: 中等查看答案及解析
-
由短周期元素或生活中常见的金属元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是( )
A. 若X是Na2CO3,C为一种温室气体,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是HCO3- 与OH-反应 ,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为过氧化钠
D. 若C的溶液遇KSCN显红色,则A可能为氮的一种氧化物
难度: 困难查看答案及解析