-
下列表述正确的是( )
A. 硅晶体具有半导体性能,可用于光导纤维
B. 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
C. 浓硫酸具有吸水性,故能使蔗糖炭化
D. SO2能使酸性KMnO4溶液褪色,体现了SO2的漂白性
难度: 中等查看答案及解析
-
下列关于指定粒子构成的几种描述中不正确的是( )
A. H3O+与OH-具有相同的质子数和电子数 B. 第85号元素的最高价为+7价
C. 37Cl与39K具有相同的中子数 D.
N与
N得电子能力相同
难度: 中等查看答案及解析
-
下列关于现行的元素周期表的说法正确的是( )
A. 元素周期表的非金属元素都位于主族和0族
B. 第ⅠA族的元素全部都是金属元素
C. 位于同一主族相邻的甲乙两种元素,甲的原子序数为x,则乙的原子序数可能为x+4
D. 除短周期外,其他周期均有18种元素
难度: 中等查看答案及解析
-
下列关于元素金属性和非金属性强弱比较的说法不正确的是( )
A. 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,不能判断钠与铁的金属活动性强弱
B. Si与H2化合所需温度远高于S与H2化合的温度,说明S的非金属强于硅
C. Na与冷水能发生反应,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D. 将大理石加入稀盐酸中,能产生CO2气体,说明C1的非金属性强于C
难度: 中等查看答案及解析
-
稀硫酸中插一块铜片,加入下列物质后,可使铜片迅速发生反应的是( )
A. 稀盐酸 B. 硫酸钠晶体 C. 硝酸钾晶体 D. 氯化钠晶体
难度: 中等查看答案及解析
-
下列现象或事实的原因相同的是( )
A. 浓硝酸和浓硫酸暴露在空气中浓度降低
B. 碳酸氢铵和碘都可以用加热法进行提纯
C. 氯水和二氧化硫气体均能使品红溶液褪色
D. 硫酸亚铁和亚硫酸钠在空气中久置后均会变质
难度: 中等查看答案及解析
-
工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2
2Fe2O3+8SO2
B. 工业上制硫酸与硝酸都用到同一工艺设备:吸收塔
C. 硫酸工业、硝酸工业都需要对工业尾气进行处理
D. 工业上制备硫酸和制硝酸涉及的反应都属于氧化还原反应
难度: 中等查看答案及解析
-
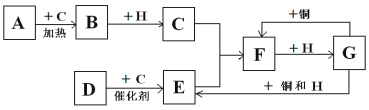
能实现下列物质间直接转化的元素是( )
单质
氧化物
酸或碱
 盐
盐A. 氮 B. 硫 C. 铁 D. 铜
难度: 中等查看答案及解析
-
已知气体的摩尔质量越小,扩散速度越快。下图所示为气体扩散速度的实验,两种气体扩散相遇时形成白色烟环。下列关于物质甲、乙的判断正确的是( )
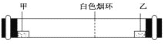
A. 甲是浓氨水,乙是浓硫酸
B. 甲是浓盐酸,乙是浓氨水
C. 甲是浓氨水,乙是浓盐酸
D. 甲是浓硫酸,乙是浓氨水
难度: 中等查看答案及解析
-
X、Y、Z均为元素周期表中前20号元素,Xa+、Yb-、Z(b+1)-简单离子的电子层结构相同,下列说法正确的是( )
A. 已知mXa+与nYb-,得m+a=n-b B. 离子半径:Yb->Z(b+1)->Xa+
C. Z(b+1)-的还原性大于Yb- D. 气态氢化物的稳定性Hb+1Z一定大于HbY
难度: 简单查看答案及解析
-
根据下表提供的信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.143
0.112
0.104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A. 氢化物的沸点为H2T < H2R
B. 单质与稀盐酸反应的剧烈程度为L<Q
C. M与T形成的化合物具有两性
D. L2+与R2-的核外电子数相同
难度: 中等查看答案及解析
-
若已发现了116号元素则下列推断正确的是:①R是金属元素②R是非金属元素③其钠盐的化学式为Na2R④其最高价氧化物对应的水化物的酸性比硫酸强⑤最外电子层有6个电子( )
A. ①③④ B. ①③⑤ C. ②④⑤ D. ①⑤
难度: 简单查看答案及解析
-
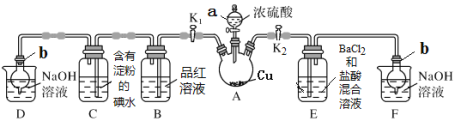
以下实验目的可以实现的是( )
A.
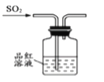 验证一定生成SO2 B.
验证一定生成SO2 B.  制备氨气
制备氨气C.
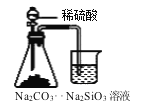 证明碳酸酸性强于硅酸 D.
证明碳酸酸性强于硅酸 D. 收集NO
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体;p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )
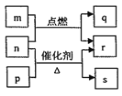
A. q与s均为酸性氧化物
B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体
D. 原子半径:X<Y<Z
难度: 中等查看答案及解析
-
下表各组物质在适当条件均可反应,其中气体(指常温时的状态)产物可能不唯一的是( )
A. 浓硫酸与锌 B. 浓硫酸与铜 C. 浓盐酸与MnO2 D. 浓氨水与CaO
难度: 中等查看答案及解析
-
下列除杂的操作方法,正确的是( )
A. NO中混有少量NO2气体:用水洗涤后再干燥
B. 食盐中混有少量NH4Cl:加过量烧碱溶液后加热蒸干
C. NH3中混有少量水蒸气:通过装有浓硫酸的洗气瓶
D. 硝酸混有少量硫酸:加适量BaCl2后再过滤
难度: 中等查看答案及解析
-
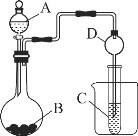
CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )
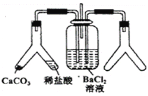
A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
难度: 中等查看答案及解析
-
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
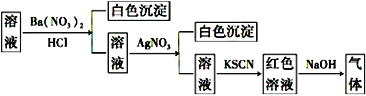
A. 原溶液中一定含有SO42- B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl- D. 原溶液中一定含有Fe3+
难度: 中等查看答案及解析
-
一定条件下,将等体积的NO2和O2的混合气体置于试管并将该试管倒置于水槽中至液面不再上升时,剩余气体的体积约为原体积的( )
A. 1/4 B. 3/4 C. 1/8 D. 3/8
难度: 中等查看答案及解析
-
稀H2SO4 和稀HNO3的混合液1L,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 2.4g B. 3.2g C. 6.4g D. 9.6g
难度: 中等查看答案及解析