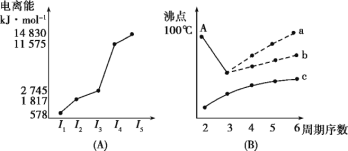
-
下列说法正确的是( )
①电子云中的一个小黑点代表一个电子
②电子云密度大的地方,说明电子在核外空间单位时间内出现的机会多
③原子轨道是指原子运行的轨道
④s电子的电子云呈球形,p电子的电子云呈哑铃形
A. ①② B. ②③
C. ③④ D. ②④
难度: 中等查看答案及解析
-
下列物质发生变化时,所克服的粒子间相互作用完全相同的是( )
A. 液态HF与液态HBr分别受热变为气体
B. 氯化铵与苯分别受热变为气体
C. 氯化钠与氯化氢分别溶解在水中
D. 碘与干冰分别受热变为气体
难度: 简单查看答案及解析
-
基态原子的核外电子排布的原则不包括( )
A. 能量守恒原理 B. 能量最低原理
C. 泡利原理 D. 洪特规则
难度: 简单查看答案及解析
-
下列分子晶体的熔、沸点高低排序正确的是( )
A. Cl2>I2
B. CCl4>SiCl4
C. NH3>PH3
D. C(CH3)4>CH3CH2CH2CH2CH3
难度: 中等查看答案及解析
-
共价键、离子键和范德华力是粒子之间的三种作用力。下列晶体①Na2O2、②SiO2、③石墨、④金刚石、⑤NaCl、⑥白磷中,含有以上其中两种作用力的是( )
A. ①②③ B. ①③⑥
C. ②④⑥ D. ①②③⑥
难度: 中等查看答案及解析
-
关于晶体的下列说法正确的是 ( )
A. 在晶体中只要有阳离子就一定有阴离子
B. 在晶体中只要有阴离子就一定有阳离子
C. 原子晶体的熔点一定比金属晶体的高
D. 分子晶体的熔点一定比金属晶体的低
难度: 中等查看答案及解析
-
下列表示钠原子的符号和图示中能反映能级差别和电子自旋状态的是( )
A.

B.
C. 1s22s22p63s1
D.
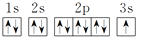
难度: 简单查看答案及解析
-
下列分子属于含有极性键的非极性分子的是( )
A. O2 B. NH3 C. H2O2 D. C2H2
难度: 简单查看答案及解析
-
下列给出的是几种氯化物的熔点和沸点:
NaCl
MgCl2
AlCl3
SiCl4
熔点/℃
801
714
190(5×101 kPa)
-70
沸点/℃
1 413
1 412
183
57.57
据表中所列数据判断下列叙述与表中相吻合的是( )
A. AlCl3在加热条件下能升华
B. SiCl4是原子晶体
C. AlCl3是典型的离子晶体
D. NaCl的晶格能比MgCl2小
难度: 中等查看答案及解析
-
下列物质性质变化规律不正确的是( )
A. 金属Na、Mg、Al的硬度依次升高
B. HI、HBr、HCl、HF的沸点依次降低
C. 干冰、冰、钠的熔点依次升高
D. O、F、H的原子半径依次减小
难度: 中等查看答案及解析
-
已知某元素+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中属于( )
A. 第ⅤB族 B. 第ⅡB族 C. 第Ⅷ族 D. 第ⅡA族
难度: 简单查看答案及解析
-
下列关于σ键和π键的理解不正确的是( )
A. σ键能单独形成,而π键一定不能单独形成
B. σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C. 双键中一定有一个σ键和一个π键,三键中一定有一个σ键和两个π键
D. 气体单质中一定存在σ键,可能存在π键
难度: 中等查看答案及解析
-
美国某国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的晶体,下列关于CO2的原子晶体的说法正确的是( )
A. CO2的原子晶体和分子晶体互为同素异形体
B. 在一定条件下,CO2的原子晶体转化为分子晶体是物理变化
C. CO2的原子晶体和分子晶体具有相同的物理性质
D. 在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与2个碳原子结合
难度: 中等查看答案及解析
-
下列中心原子的杂化轨道类型和分子立体构型不正确的是( )
A. PCl3中P原子采用sp3杂化,为三角锥形
B. BCl3中B原子采用sp2杂化,为平面三角形
C. CS2中C原子采用sp杂化,为直线形
D. H2S中S原子采用sp杂化,为直线形
难度: 中等查看答案及解析
-
硅酸盐与二氧化硅一样,都以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
,其中○表示氧原子,黑点表示硅原子。硅氧四面体通过不同方式的连接可以组成不同的多聚硅酸根离子。如图所示为某无限长单键的多聚硅酸根离子的结构,试确定该阴离子中硅原子与氧原子的个数之比为( )

A. 1∶2 B. 1∶3 C. 1∶4 D. 2∶5
难度: 中等查看答案及解析
-
配位化合物Pt(NH3)2Cl2有顺铂和反铂两种同分异构体。顺铂在水中的溶解度较大,具有抗癌作用;反铂在水中的溶解度小,无抗癌作用。下列说法正确的是( )
A. 顺铂在苯等有机溶剂中溶解度小于反铂
B. 已知Pt位于元素周期表第10纵行,则Pt是d区的ⅧB 族元素
C. 分子中Pt和N之间为离子键
D. N原子杂化方式为sp2杂化
难度: 中等查看答案及解析
-
铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是( )
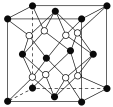
A. 铁镁合金的化学式为Mg2Fe
B. 晶体中存在的化学键类型为金属键
C. 晶格能:氧化钙>氧化镁
D. 该晶胞的质量是
g(NA表示阿伏加德罗常数的值)
难度: 中等查看答案及解析